✧Чернила и ручка выживальщика. Часть II. Приготовление чернил

1. Начало ТУТ.
2. Объем огромен. Но плодить часть III не вижу смысла.
3. В начале будет много химии. Но серьезно вникать совершенно не обязательно.
Сверхзадача — замена в галловых чернилах:
— вытяжки из галлов на вытяжки из соплодий ольхи или коры дуба;
— сульфата железа FeSO₄ на продукты взаимодействия лимонной или уксусной кислоты c железными гвоздями.
ПЛАН действий.
1. Получить железо-галловые чернила и подобрать для них оптимальные соотношения компонентов:
— вытяжки из галлов
— железного купороса FeSO₄·7H₂О
— камеди
— воды
Далее этот состав принять за эталон.
2. В эталоне попробовать заменить вытяжки из галлов на ольху/дуб.
Все остальное оставить неизменным. Посмотреть что получится.
3. В эталоне попробовать заменить FeSO₄·7H₂О на р-ры, полученные при взаимодействии лимонной/уксусной кислоты c гвоздями.
Все остальное оставить неизменным. Посмотреть что получится.
4. Создать чернила из компонентов:
— вытяжки из соплодий ольхи или коры дуба
— железосодержащий р-р на основе лимонной или уксусной кислоты
— камедь
— вода
То, что лимонка растворяет почти любые стали (включая инструментальные) стало понятно после просмотра вот этого ВИДЕО.
Товарищ приготовил 300 г ~16% р-ра. Погрузил в него стальной болт М6 и сверло 5.5 мм. Правда, он туда еще бросил 1 таблетку гидроперита (1,5 г)***. Зачем? Ведь до начала съёмок этого видео [по заявлению автора] он положил обломок сверла в р-р лимонки без всякого там гидроперита и через 2 недели оный был полностью разъеден и разрушен.
Результаты сами посмотрите на видео, там все наглядно показано.
Вместо сока из лимонов была использована «кристаллическая» лимонная кислота C₆H₈O₇·H₂О, купленная здесь.
Сок лимонов не использовался по 2 причинам:
— жуткие цены в магазинах (а нужно было бы купить несколько кг лимонов)
— концентрация C₆H₈O₇ в лимонном соке неизвестна, т.к. может гулять в широких пределах.
Навеска m(C₆H₈O₇·H₂О) = 50.0 г, бумажка весит 1.0 г.
М(C₆H₈O₇)=182 г/моль, М(H₂О)=18 г/моль, М(C₆H₈O₇·H₂О)=200 г/моль
50 г C₆H₈O₇·H₂О содержит 1/4 моль C₆H₈O₇, а m(C₆H₈O₇) = 45.5 г.
 В чистом баллоне из-под минералки было отмерено 500 г воды и приготовлен р-р
В чистом баллоне из-под минералки было отмерено 500 г воды и приготовлен р-р
w(C₆H₈O₇)=(45.5 /550)·100%=8.3% — как в среднестатистическом лимонном соке.
Лимонка великолепно растворяется в воде, даже в холодной растворимость 133г(C₆H₈O₇)/100г(H₂О).
Гвозди были найдены на балконе. Они там хранились много лет в открытой банке из-под кофе. При этом совершенно не заржавели. Что как бы наводит на мысль, что на их поверхности есть следы машинного масла.
Обработал горячим р-ром фейри в воде. Раствор стал мутным, светло-серым. Потом промывка в горячей и холодной воде. Сушка на салфетках. Взвешивание.
Молярная масса железа 55,85 г/моль. Навеска — 57 г (бумажка — 0.4 г).
 Это примерно 1 моль железа, с учетом того, что стали еще содержат углерод, контролируемые примеси (лигатура) и неконтролируемые примеси.
Это примерно 1 моль железа, с учетом того, что стали еще содержат углерод, контролируемые примеси (лигатура) и неконтролируемые примеси.
По ГОСТ 283-75 при производстве гвоздей используется проволока из низкоуглеродистой стали марок Ст.1, Ст. 2, Ст. 3, Ст. 4, Ст. 10, Ст. 15. В переводе на человеческий — углерода там 0.01-0.15%. Лигатуры нет. Но есть немного неконтролируемых примесей.
Самый важный момент (из спрятанного под спойлером).
Как оказалось в дальнейшем, образование хелатных комплексов Fe⁺² и Fe⁺³ с цитрат-ионами и целыми молекулами лимонной кислоты реально сказывается на интенсивности окраски чернил. Они ее ослабляют в разной степени (в зависимости от состава смеси).
После переноса гвоздей в кислый раствор водород пошел не сразу, индукционный период ~5-10 мин. Потом стали выделяться мелкие пузырьки. Довольно активно.
Через 15-16 часов:
 Водород выделяется с постоянной скоростью. Не особо бурно, но стабильно. На фото получилось не очень — пока возился с баллоном, пузырьки со стенок убежали. Гвозди стали «вороненые», что не было неожиданностью (воронение Оппинеля в р-ре лимонки). Раствор приобрел слабо желтую окраску. Баллон закрыт не плотно, что бы не разорвало. Если полностью открутить крышку и понюхать — чувствуется запах как в слесарной мастерской.
Водород выделяется с постоянной скоростью. Не особо бурно, но стабильно. На фото получилось не очень — пока возился с баллоном, пузырьки со стенок убежали. Гвозди стали «вороненые», что не было неожиданностью (воронение Оппинеля в р-ре лимонки). Раствор приобрел слабо желтую окраску. Баллон закрыт не плотно, что бы не разорвало. Если полностью открутить крышку и понюхать — чувствуется запах как в слесарной мастерской.
Если кратко — водород выделяется менее активно, чем в 8.3% р-ре лимонки первые трое суток. При этом молярная концентрация лимонной к-ы в 3 раза меньше (182/60=3). Но это на интенсивность взаимодействия не влияет, т.к. при концентрациях >0.1% подавляющее кол-во молекул несильных к-т пребывают в недиссоциированном виде и не влияют на pH р-ра.
Зато лимонка примерно в 6.5 раз сильнее уксусной — нужно посчитать отношение Кд двух кислот по первой ступени (см. выше под спойлером «Особенности лимонной кислоты») и извлечь квадратный корень. А это приводит к сдвигу pH в кислую сторону почти на единицу:
pH = — lg(6.5) = 0.8
На фото — гвозди в уксусной к-те (через сутки) и лимонной к-те (на 6 день).
 Уксусная к-та совершенно свежая, не выдохшаяся, куплена в «Пятерочке» накануне. Герметичная емкость была вскрыта за пару минут до начала приготовления раствора.
Уксусная к-та совершенно свежая, не выдохшаяся, куплена в «Пятерочке» накануне. Герметичная емкость была вскрыта за пару минут до начала приготовления раствора.
Остаток чистых, отмытых гвоздей потянул 10.3 г. Это 0.184 моль Fe.
М(СН₃СООН) = 60.05 г/моль. А 0.184 моль СН₃СООН — это 11.05 г. Реакция идет по уравнению
Fe + 2СН₃СООН = Fe(СН₃СОО)₂ + H₂ __ соотношение 1 моль Fe: 2 моль СН₃СООН
Значит, для растворения 10.3 г чистого железа нужно как минимум 22.10 г СН₃СООН.
22.10 г СН₃СООН содержатся в 245.5 г уксуса (9%).
Что бы железо и здесь оказалось в огромном избытке я отмерил 107,9 г уксуса.
На этом фото — гвозди в уксусной к-те на 8 сутки (слева) и лимонной к-те на 13 день (справа). Взаимодействие идет вяло в обеих емкостях. Но в лимонной к-те до сих пор чуть заметнее. Наверное, просто гвоздей в 5 раз больше.
 Обратите внимание на цвет р-ра слева. Железо переходит в р-р в виде бесцветных ионов Fe⁺². Кислород воздуха медленно окисляет железо Fe⁺² + е⁻ = Fe⁺³. Ионы Fe⁺³ из различных солей окрашивают водные р-ры в цвета от желтого до красно-бурого. Здесь — нечто желто-розоватое. Ибо ацетат железа(III) суть красно-коричневые кристаллы. Совсем слабые р-ры ацетата железа(III) желтоватые, при увеличении концентрации — постепенно розовеют, потом краснеют.
Обратите внимание на цвет р-ра слева. Железо переходит в р-р в виде бесцветных ионов Fe⁺². Кислород воздуха медленно окисляет железо Fe⁺² + е⁻ = Fe⁺³. Ионы Fe⁺³ из различных солей окрашивают водные р-ры в цвета от желтого до красно-бурого. Здесь — нечто желто-розоватое. Ибо ацетат железа(III) суть красно-коричневые кристаллы. Совсем слабые р-ры ацетата железа(III) желтоватые, при увеличении концентрации — постепенно розовеют, потом краснеют.
Наконец-то померил рН растворов универсальной индикаторной бумагой. Её теперь часто называют «лакмусовой», даже производители. С т.з. химии это совершенно неправильно, но для широких масс покупателей вполне допустимо. Ибо настоящая лакмусовая бумага не выпускается уже лет 40 (дорого и смысла в ней нет), а что такое «универсальная индикаторная» мало кто знает.
Шкала расшифровки сделанапо-идиотски по-китайски, в шахматном порядке, что несколько усложняет сравнение окрасок.
 Сейчас в уксуснокислом р-ре рН~4-4.5, а в лимоннокислом р-ре рН~3.
Сейчас в уксуснокислом р-ре рН~4-4.5, а в лимоннокислом р-ре рН~3.
Изначально было 3 и 2 соответственно.
Картинка на фото отличается от того, что я вижу живьем. Цветовые таблицы подгоняются под восприятие [среднестатистическим] человеческим глазом. А камера это дело фиксирует немного по-другому, даже если откалибровать ББ по серой карте.
Есть мнение, что кислоты почти полностью прореагировали, их концентрация понизилась примерно на 2 порядка. Дело в том, что 1 ед.рН — это изменение в концентрации:
— для сильной кислоты в 10 раз
— для слабой (уксусной, лимонной и др.) в 100 раз.
Если когда-нибудь напишу обзор про измерения рН, я этот момент подробно разжую.
Удивительно, но камеди я не нашел. Ни вишневой, ни какой другой.
Во дворах нашего микрорайона растет ~20 косточковых деревьев: алыча и урюк. Но камеди нет.
У соседей на даче есть несколько вишневых деревьев. Но они целые-невредимые, без камеди.
Пришлось разориться и заказать 200 г гуммиарабика Gum Arabic Norevo за 520 руб (была скидка 100 руб). В других местах еще дороже. Если честно, я больше всего боялся, что подсунут декстрин, который намного дешевле и вообще некошерный. То, что пришло было жутко похоже на кукурузный декстрин — такой же бело-желтоватый порошок. Все декстрины получают нареванием некого крахмала до 200-250 град. Длинные полимерные цепи крахмала разваливаются на более короткие. В отличии от крахмалов декстрины хорошо растворимы воде, образуют клейкую гелеобразную массу. В прошлой жизни из крахмала, «прожаренного» на сковороде делали клей для обоев и окон. Держался он не долго, несколько лет, но зато практически ничего не стоил. И тараканы его любили кушать. Зато никакой синтетики, все природное, все натуральное…
Полез в и-нет и через 5 мин выяснил, что растворы всех декстринов дают положительную йодную пробу (посинение вплоть до почернения). И даже более чувствительны и йоду, чем исходные крахмалы. А р-ры всех камедей — нет. Насчет крахмалов/декстринов никто и не сомневался (окрашивание йодом — природоведение, 5 кл.). А про гуммиарабик и прочие подобные гумми (камеди) был не в курсе.
На фото слева в стопке чайная ложка моего гуммиарабика в 30 мл воды, а справа — разрезанная сырая картофелина. Туда и туда добавил по 2 жирные капли йода. Купленный гумми показал отсутствие даже следов крахмала, декстрина или чего-то подобного.
 Я даже не ожидал, что на поверхности разрезанной картошки окажется так много крахмала.:)
Я даже не ожидал, что на поверхности разрезанной картошки окажется так много крахмала.:)
Как уже было отмечено в 1 части обзора, сушеные галлы были куплены тут. Товар пришел в 2 зип-пакетах: 103 г (покупка) + 25 г (подарок от продавца). На фото справа — содержимое второго пакетика после измельчения.
 В пластиковые емкости были помещены 3 навески по 10 г измельченных галлов и залиты жидкостями для вытяжки, массой 200-210 г:
В пластиковые емкости были помещены 3 навески по 10 г измельченных галлов и залиты жидкостями для вытяжки, массой 200-210 г:
— вода
— 9% р-р уксусной к-ты
— 9% р-р лимонной к-ты.
Это они через 4 часа экстрагирования
 Фото получилось не очень — плохое освещение. Поэтому словами:
Фото получилось не очень — плохое освещение. Поэтому словами:
— водная вытяжка прозрачна, с ярким, насыщенным коричневым цветом,
— кислые вытяжки мутноваты и светлее.
Причем, такое состояние растворы приобрели почти сразу же, в течении первых 10-15 мин.
Это через 7 часов экстрагирования
 — водная вытяжка стала мутновата, окраска стала светлее,
— водная вытяжка стала мутновата, окраска стала светлее,
— кислые вытяжки не изменились.
Через 48 часов экстрагирования. Но изменения произошли часов 10-12 назад. Просто дождался утра, поставил на подоконник, сделал положительную экспокоррекцию + подтянул в редакторе.


— водная вытяжка стала совсем мутной и почти непрозрачной, выпал светлый осадок,
— кислые вытяжки стали прозрачными, выпало немного осадков (лимоннокислая вытяжка несколько светлее уксусной).
Такое впечатление, что в нейтральном р-ре поселились дрожжи и пошло что-то типа брожения-разложения. Так оно и оказалось.
Забегая немного вперед — водная вытяжка через 9 суток:
 Раствор мутный, рН=5. На дне — дрожжевой осадок. На поверхности появилась плесень (споровые тела дрожжей-?). Все идет «по плану», даже с опережением: плесень д.б. появиться через несколько недель, а тут — через одну. Если, конечно, рецепт от Э. Линдквиста переведен правильно — он был в первой части обзора, но что бы не искать повторю:
Раствор мутный, рН=5. На дне — дрожжевой осадок. На поверхности появилась плесень (споровые тела дрожжей-?). Все идет «по плану», даже с опережением: плесень д.б. появиться через несколько недель, а тут — через одну. Если, конечно, рецепт от Э. Линдквиста переведен правильно — он был в первой части обзора, но что бы не искать повторю:
А кислые вытяжки давно не меняются. Прозрачные, цвет коньячный (см. выше).
Вернемся немного назад.
Итак, прошло ровно 3 суток после замеса. Состояние вытяжек такое же, как после 48 часов (см. выше). Если верить интернетам, рекомендуемое время подготовки вытяжек (без нагревания и без ферментации) 7-10 суток. Тем не менее, решил сделать пробный замес чернил. Отобраны пробы вытяжек по ~5 мл.
 Слева — насыщенный р-р железного купороса, приготовленный из расчета 26.3г/100г(H₂О). Взято из «Краткого справочника химика», 1971г.
Слева — насыщенный р-р железного купороса, приготовленный из расчета 26.3г/100г(H₂О). Взято из «Краткого справочника химика», 1971г.
 Прозрачные зеленоватые кристаллы купороса при растворении дали грязно-желтый мутный раствор. Наглядная иллюстрация к школьной теме «Гидролиз солей». Я знаю, как можно было избежать помутнения, нужно было заменить «классический» купорос FeSO₄·7H₂О на железо-аммонийные квасцы. Но во всех источниках фигурирует исключительно FeSO₄·7H₂О, а значит, помутнение (образование основных солей) на конечный результат не влияет.
Прозрачные зеленоватые кристаллы купороса при растворении дали грязно-желтый мутный раствор. Наглядная иллюстрация к школьной теме «Гидролиз солей». Я знаю, как можно было избежать помутнения, нужно было заменить «классический» купорос FeSO₄·7H₂О на железо-аммонийные квасцы. Но во всех источниках фигурирует исключительно FeSO₄·7H₂О, а значит, помутнение (образование основных солей) на конечный результат не влияет.
Пока без клея
Шприцом внес по 0.5 мл р-ра купороса в каждый из пузырьков.
 Как и ожидалось, лимонка связывает ионы железа в комплексы и мешает образованию комплексов с танинами. Решил добавить еще по 0.5 мл р-ра купороса. Похоже, не зря.
Как и ожидалось, лимонка связывает ионы железа в комплексы и мешает образованию комплексов с танинами. Решил добавить еще по 0.5 мл р-ра купороса. Похоже, не зря.
 Результат (самопальная бамбуковая ручка):
Результат (самопальная бамбуковая ручка):
 Очень хорошо выражен эффект «проявки изображения»: вначале пишешь светло-серой водичкой (в случае лимонки — светло-желтой), а потом прямо на глазах написанное начинает темнеть.
Очень хорошо выражен эффект «проявки изображения»: вначале пишешь светло-серой водичкой (в случае лимонки — светло-желтой), а потом прямо на глазах написанное начинает темнеть.
Теперь с гуммиарабиком
В каждый пузырек добавил по 0.5 г гуммиарабика. В водной и уксуснокислой вытяжках гумми растворился при помешивании в течении 5-7 мин. А в лимоннокислой — растворялся не так охотно.
 Решил подождать 20-30 мин, что бы смеси настоялись. И от скуки окунул индикаторные бумажки в чернила. Лимоннокислые чернила показали явно кислую среду (рН~2). А остальные похвастались своим красителем.
Решил подождать 20-30 мин, что бы смеси настоялись. И от скуки окунул индикаторные бумажки в чернила. Лимоннокислые чернила показали явно кислую среду (рН~2). А остальные похвастались своим красителем.
 Минут через 20-25 гумми таки растворился в лимоннокислой вытяжке.
Минут через 20-25 гумми таки растворился в лимоннокислой вытяжке.
 Лимоннокислые чернила почему-то плохо смачивали металлическое перо, приходилось писать по 2 буквы между маканиями.
Лимоннокислые чернила почему-то плохо смачивали металлическое перо, приходилось писать по 2 буквы между маканиями.
Для дальнейших опытов мне нужно было освободить 2 пузырька. Поэтому чернила на лимонке я просто вылил. А содержимое двух остальных пузырьков слил в один. Далее это будет называться как «смесь вытяжек».
3.5. Замена №1:
На момент проведения эксперимента гвозди настаивались в уксусе 15 суток.
Делалось по схеме, изложенной выше с небольшими изменениями:
— насыщенный р-р FeSO₄ (1 мл) заменен на 4 мл р-р ацетата Fe из гвоздей (шприц)
— вместо 0.5 г сухого гуммиарабика добавлялся 1 г.
После введения 4 мл р-ра ацетата Fe в пробы по 5 мл:
 Замес гуммиарабика (низ ватных палочек со второй ваткой отрезан)
Замес гуммиарабика (низ ватных палочек со второй ваткой отрезан)
 Результат:
Результат:

3.6. Замена №2:
На момент проведения эксперимента гвозди настаивались в р-ре лимонной к-ты 20 суток. Схема проведения и дозировки — точно такие же, как в случае ацетата:
— вытяжка
— 4 мл р-р цитрата Fe из гвоздей (шприц)
— 1 г сухого гуммиарабика.
Введение цитрата не дало такого насыщенной сине-черной окраски в водной и уксусной вытяжках, как в предыдущем случае
 Результат:
Результат:

Через 12 суток. Внешне вытяжки практически не изменились. Ну, разве что появилась плесень (см. выше). Схема изготовления чернил прежняя.

По классике, смешивание основных компонентов натуральных чернил (вытяжка танинов + р-р с ионами железа + клей) происходит в момент их приготовления. Но я решил попробовать получить окрашенный раствор, содержащий комплексы полифенолы + ионы железа в один этап. А процесс приготовления продукта свести к простому добавлению гуммиарабика.
Собственно, идеяпроста как трусы лежит на поверхности:
— вода вытягивает танины из источника (дубовая кора и т.п.)
— параллельно с этим гвозди в кислоте дают ионы железа: Fe + 2H⁺ = Fe⁺² + H₂
— ионы железа дают с танинами в р-ре комплексы Fe⁺²•полифенолы.
Основной проблемой этой схемы является принципиальная возможность окисления ионов железа Fe⁺² до Fe⁺³ атмосферным кислородом в кислой среде с образованием плохо растворимых комплексов Fe⁺³•полифенолы. Они как правило черные (что хорошо), но не пойдут в бумагу (что плохо) и общая концентрация их в смеси с гумми неведома. Процесс окисления Fe⁺² до Fe⁺³ не шибко шустрый, но и гвозди в кислоте вымачиваются продолговато — сутками.
Была отмеряна навеска пиленной дубовой коры 10 г (0.8 г — вес бумажки). Каким образом та кора была получена рассказано в первой части статьи.
 Потом было добавлено 30 г отмытых гвоздей и 220 г уксуса 9%. Гвозди опять в огромном избытке (трехкратном). Это для того, что бы увеличить площадь поверхности соприкосновения металла с кислым р-ром и реакция шла повеселее.
Потом было добавлено 30 г отмытых гвоздей и 220 г уксуса 9%. Гвозди опять в огромном избытке (трехкратном). Это для того, что бы увеличить площадь поверхности соприкосновения металла с кислым р-ром и реакция шла повеселее.
Через 30 мин после замеса:

Через 25 часов после замеса:

Налил в рюмку 10-15 мл и стал делать пробы на бумаге, периодически добавляя гуммиарабик
 Окраска пока блекловатая, а с гумми тоже надо не перебарщивать.
Окраска пока блекловатая, а с гумми тоже надо не перебарщивать.
Интересный момент, в процессе добавления клея чернила темнели, а в конце стали черными и непрозрачными.
 Но это не усилило окраску написанного, скорее наоборот. Мне кажется, причиной потемнения являлись многократные интенсивные перемешивания после введения очередной дозы клея. При этом в раствор попадало немало воздуха и железо окислялось Fe⁺² + е⁻ = Fe⁺³. Комплексы Fe⁺² с танинами водорастворимы и светлее, а комплексы Fe⁺³ практ. нерастворимы и чисто черные. Получается разряженная взвесь мелких черных частиц в желеобразном б/ц р-ре, дающая блеклую писанину.
Но это не усилило окраску написанного, скорее наоборот. Мне кажется, причиной потемнения являлись многократные интенсивные перемешивания после введения очередной дозы клея. При этом в раствор попадало немало воздуха и железо окислялось Fe⁺² + е⁻ = Fe⁺³. Комплексы Fe⁺² с танинами водорастворимы и светлее, а комплексы Fe⁺³ практ. нерастворимы и чисто черные. Получается разряженная взвесь мелких черных частиц в желеобразном б/ц р-ре, дающая блеклую писанину.
Через 3 суток. Черная окраску р-р приобрел еще сутки назад. Причем, он не прозрачен даже после отбора пробы в рюмку.
 Что без клея, что с гумми (3 г) — ничего толком пока не получилось
Что без клея, что с гумми (3 г) — ничего толком пока не получилось

Через 13 суток.

Собственно, стало понятно, в вытяжках дуба не хватает дубильных веществ (танинов). Потому и писанина блекловата. А как извлекают дубильные в-ва из коры? Например, для количественного определения оных? Думаете от балды — кто во что горазд? Ан нет, оказывается у фармацевтов существуют свои ГОСТы. Они собраны в одну кучу, которая называются Государственная фармакопея. Аналогичная штука есть и в сопредельных странах, например у белорусов.
Так вот, находим ОФС.1.5.3.0008.15 «Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах» и читаем
 Понятно, что 2 г на 250 мл воды — это для удобства проведения количественного анализа навески. Для чернил более концентрированный р-р будет поинтереснее. Но все по порядку.
Понятно, что 2 г на 250 мл воды — это для удобства проведения количественного анализа навески. Для чернил более концентрированный р-р будет поинтереснее. Но все по порядку.
Отмерил 10 г коры, поместил в 400 мл воды в аутентичной кружке из люминя.
 Довел до кипения, кипятил ~30 мин без крышки на малом огне. И пару раз подливал горячей воды, т.к. активно выкипало (наверное зря, но хотелось экстрагировать по максимуму). Потом дал остыть и профильтровал через туалетную бумагу (зачем — не знаю, в фарме — фильтруют).
Довел до кипения, кипятил ~30 мин без крышки на малом огне. И пару раз подливал горячей воды, т.к. активно выкипало (наверное зря, но хотелось экстрагировать по максимуму). Потом дал остыть и профильтровал через туалетную бумагу (зачем — не знаю, в фарме — фильтруют).
 Что получилось:
Что получилось:
 В левой рюмке — отвар без всего, в правой — с 1 г железного купороса и 1 г гуммиарабика. Запах приятный — отвар пахнет даже не деревяшками, а древесным соком (типа березового или кленового).
В левой рюмке — отвар без всего, в правой — с 1 г железного купороса и 1 г гуммиарабика. Запах приятный — отвар пахнет даже не деревяшками, а древесным соком (типа березового или кленового).
 Писанина после проявления (10 мин)
Писанина после проявления (10 мин)
 Мда, блекловато будет.
Мда, блекловато будет.
Решил увеличить концентрацию танинов путем выпаривания. В той же кружке на малом огне уменьшил массу р-ра ровно(!) на 60%, если точнее — на 59,7%. Только не спрашивайте, как такое возможно. Видать, на втором месяце телодвижений в сторону достижения намеченной цели пришло-таки мастерство. Нетрудно посчитать: концентрация растворенного в отваре увеличилась в 2.5 раза.
Результаты с двумя разными источниками ионов железа:
 Вроде, получилось более-менее сносно. Как делать отвар ольховых «шишек» я теперь представляю.
Вроде, получилось более-менее сносно. Как делать отвар ольховых «шишек» я теперь представляю.
Кстати, во втором случае (ацетат из гвоздей) написанное под некоторыми углами имеет благородный бронзовый отлив. На фото не видно. Это, конечно, не лухари из того обзора, но все же. Интересно, через неделю-месяц-год хранения эта фича не исчезнет?
Через 13 суток настаивания остатки реакционной смеси (127 г) аккуратно выпарил на минимальном огне газовой конфорки до 25 г. Увеличение концентрации — в 5 раз.
Если бы жена с дочкой не уехали в командировку на неделю, то я бы ничего подобного не сделал. Ибо вытяжки на кухне нет, а уксус пёр по всей квартире — мама не горюй.


Получилось вроде как читабельно.
Вытяжка №1
Все делалось точно также как в случае коры дуба в уксусе с гвоздями. Для корректного сравнения. Рецептура абсолютно такая же:
10 г соплодий
30 г отмытых гвоздей
220 г уксуса 9%
Вытяжка №2
20 г соплодий
380 г водопроводной воды
Соплодия выглядят как малюсенькие «шишки», часто используются в новогодних поделках:

Через 2 часа после замесов:

Через 3 суток.

 Диагноз понятен — надо и здесь делать вытяжку при кипячении.
Диагноз понятен — надо и здесь делать вытяжку при кипячении.
Все тоже самое, как в случае коры и гвоздей в уксусе. 135 г → 33 г. Увеличение концентрации — в 4 раза.
 По сравнению с (кора+уксус+гвозди) получилось несколько более блекло. Возможные причины:
По сравнению с (кора+уксус+гвозди) получилось несколько более блекло. Возможные причины:
— отмачивание в уксусе с гвоздями 10 сут., а не 13 [не важно]
— концентрирование вытяжки 4х, а не 5х [не существенно]
— концентрация танинов в данных соплодиях несколько меньше, чем в сабжевой стружке дубовой коры. [а вот это наиболее вероятно]
 Но в конечном итоге — вполне себе вменяемо и читаемо. И это — главное.
Но в конечном итоге — вполне себе вменяемо и читаемо. И это — главное.
~~~~~~~~~~~~~~~~~~~~~~~
~~~~~~~~~~~~~~~~~~~~~~~
ИТОГО: задачи обзора в целом выполнены. Правда, не всегда все шло по плану. Но такое для поисковых работ — обычное дело.
~~~~~~~~~~~~~~~~~~~~~~~
~~~~~~~~~~~~~~~~~~~~~~~
1. Основная проблема изготовления железо-таниновых чернил из подручных материалов — это длительность процесса получения ионов железа в псевдо-походных («выжывальщецких») условиях. Настаивание гвоздей и других мелких железок в кислых растворах желательно проводить не менее 3-4 суток. Потом интенсивность взаимодействия снижается настолько, что ждать далее — скорее всего бессмысленно.
2. Ацетаты в целом предпочтительнее более сложных по строению и хим. свойствам солей органических кислот (цитратов и др.). Уксус-содержащее сырье в принципе можно получить в ходе уксуснокислого брожения всего сахар-содержащего в воде. Начиная с тертого сахарного тростника и заканчивая медом диких пчел. [шутка юмора]
3. При наличии дубовых галлов, чернила получаются без проблем. Любым способом. Можно длительным вытягиванием водой или кислым раствором. В качестве кислого р-ра уксус предпочтительнее лимонной кислоты.
Можно по-быстрому — кипячением галлов в воде или кислом р-ре.
Думаю, можно сразу же замачивать галлы с гвоздями в кислых р-рах. При этом выпаривать в конце не обязательно.
Кстати, галлы бывают не только дубовые. Но высокое содержание в них танинов мало предсказуемо.
4. Готовить вытяжки из дубовой коры и соплодий ольхи путем длительного (многосуточного) вымачивания в воде бессмысленно — концентрация танинов маловата. Все равно потом нужно кипячение с упариванием.
Оптимальным способом является:
— замес: природный источник танинов (любой) + кислый раствор (любой) + железяки с развитой поверхностью (какие найдете),
— выдержка от 3 суток и более (пока от железяк идут пузыри в замесе),
— максимально возможное выпаривание реакционной смеси,
— после охлаждения: добавление клея (типа камеди или живицы, возможно использование декстрина из крахмал-содержащих материалов) — не обязательно, но весьма желательно (иначе — скорее всего будет расплывадзэ на пишущей поверхности).
5. Думаю, что вместо дубовой коры и соплодий ольхи можно и нужно попробовать использовать обычный зверобой. В сухой траве зверобоя содержится 8-10% танинов и значительно меньше проблем с поиском и заготовкой. Я этот вариант не прорабатывал, т.к. собирание исходных компонентов в кучку + прикидочные опыты происходили в апреле-начале мая и с дикорастущим зверобоем была напряженка. А покупать в аптеке такую бросовую вещь, как трава зверобоя, религия не позволила. И нельзя объять необъятное, пусть другие пробуют по описанным методикам.
6. В принципе, можно пробовать толченые желуди, струганную кору ольхи, ели, лиственницы и т.п. Повторюсь — источников танинов навалом. А ежели по концентрации хватать не будет, всегда можно сильно упарить.
Проблемой являются только ионы железа в растворе. Нашарашить их по-быстрому в достаточном количестве из бросовых железяк в разбавленных р-рах несильных органических кислот вряд ли получится.
А теперь главное: после длительной возни с самопальными чернилами, обычная «Радуга» начинает восприниматься как технологическое чудо. Наверное, так оно и есть.
Всего доброго.
P.S. Эффект «проявления» чернил.
Уксусная вытяжка галлов + р-р цитрата из гвоздей.
Ускорение 4х:
 Исходное ВИДЕО (без ускорения).
Исходное ВИДЕО (без ускорения).
А вот тоже самое через 20-30 мин. после писанины:
 Тоже самое на бумаге в клеточку:
Тоже самое на бумаге в клеточку:

2. Объем огромен. Но плодить часть III не вижу смысла.
3. В начале будет много химии. Но серьезно вникать совершенно не обязательно.
Сверхзадача — замена в галловых чернилах:
— вытяжки из галлов на вытяжки из соплодий ольхи или коры дуба;
— сульфата железа FeSO₄ на продукты взаимодействия лимонной или уксусной кислоты c железными гвоздями.
ПЛАН действий.
1. Получить железо-галловые чернила и подобрать для них оптимальные соотношения компонентов:
— вытяжки из галлов
— железного купороса FeSO₄·7H₂О
— камеди
— воды
Далее этот состав принять за эталон.
2. В эталоне попробовать заменить вытяжки из галлов на ольху/дуб.
Все остальное оставить неизменным. Посмотреть что получится.
3. В эталоне попробовать заменить FeSO₄·7H₂О на р-ры, полученные при взаимодействии лимонной/уксусной кислоты c гвоздями.
Все остальное оставить неизменным. Посмотреть что получится.
4. Создать чернила из компонентов:
— вытяжки из соплодий ольхи или коры дуба
— железосодержащий р-р на основе лимонной или уксусной кислоты
— камедь
— вода
3. Приготовление чернил из галлов
3.1. Опыты по получению солей железа при взаимодействии с органическими кислотами
3.1.1. Получение р-ра лимоннокислого железа (цитрата железа)
То, что лимонка растворяет почти любые стали (включая инструментальные) стало понятно после просмотра вот этого ВИДЕО.
Товарищ приготовил 300 г ~16% р-ра. Погрузил в него стальной болт М6 и сверло 5.5 мм. Правда, он туда еще бросил 1 таблетку гидроперита (1,5 г)***. Зачем? Ведь до начала съёмок этого видео [по заявлению автора] он положил обломок сверла в р-р лимонки без всякого там гидроперита и через 2 недели оный был полностью разъеден и разрушен.
Результаты сами посмотрите на видео, там все наглядно показано.
***Примечание
Совершенно бессмысленная затея. Гидроперит «содержит» 36,16 % перекиси водорода. Из той таблетки может быть получено максимум 0.54 г перекиси H₂О₂. Концентрация перекиси в сабжевом р-ре будет ничтожна w(H₂О₂)=(0.54 /300)·100%=0.18%. Кроме того, вся H₂О₂ разложится на первых минутах травления сталей. А эксперимент продолжался много недель…
Вместо сока из лимонов была использована «кристаллическая» лимонная кислота C₆H₈O₇·H₂О, купленная здесь.
Сок лимонов не использовался по 2 причинам:
— жуткие цены в магазинах (а нужно было бы купить несколько кг лимонов)
— концентрация C₆H₈O₇ в лимонном соке неизвестна, т.к. может гулять в широких пределах.
Навеска m(C₆H₈O₇·H₂О) = 50.0 г, бумажка весит 1.0 г.
М(C₆H₈O₇)=182 г/моль, М(H₂О)=18 г/моль, М(C₆H₈O₇·H₂О)=200 г/моль
50 г C₆H₈O₇·H₂О содержит 1/4 моль C₆H₈O₇, а m(C₆H₈O₇) = 45.5 г.
 В чистом баллоне из-под минералки было отмерено 500 г воды и приготовлен р-р
В чистом баллоне из-под минералки было отмерено 500 г воды и приготовлен р-р w(C₆H₈O₇)=(45.5 /550)·100%=8.3% — как в среднестатистическом лимонном соке.
Лимонка великолепно растворяется в воде, даже в холодной растворимость 133г(C₆H₈O₇)/100г(H₂О).
Гвозди были найдены на балконе. Они там хранились много лет в открытой банке из-под кофе. При этом совершенно не заржавели. Что как бы наводит на мысль, что на их поверхности есть следы машинного масла.
Обработал горячим р-ром фейри в воде. Раствор стал мутным, светло-серым. Потом промывка в горячей и холодной воде. Сушка на салфетках. Взвешивание.
Молярная масса железа 55,85 г/моль. Навеска — 57 г (бумажка — 0.4 г).
 Это примерно 1 моль железа, с учетом того, что стали еще содержат углерод, контролируемые примеси (лигатура) и неконтролируемые примеси.
Это примерно 1 моль железа, с учетом того, что стали еще содержат углерод, контролируемые примеси (лигатура) и неконтролируемые примеси.По ГОСТ 283-75 при производстве гвоздей используется проволока из низкоуглеродистой стали марок Ст.1, Ст. 2, Ст. 3, Ст. 4, Ст. 10, Ст. 15. В переводе на человеческий — углерода там 0.01-0.15%. Лигатуры нет. Но есть немного неконтролируемых примесей.
Особенности лимонной кислоты. И почему гвозди взяты в огромном избытке. Для тех, кто дружит с химией
Дело в том, что я не знаю что будет находиться в р-ре после окончания взаимодействия. Да и никто толком не знает. Ибо возможна куча вариантов. Лимонная к-та — это вам не какая-то там тупо предсказуемая уксусная. Тут все довольно сложно и запутанно.
1) Лимонная к-та считается трехосновной и «средней» силы***.
Раз она трехосновная, ее брутто-формулу можно написать как Н₃(C₆H₅O₇), или Н₃А (принято в неорганической химии), или АН₃ (принято в органической химии). Она может давать 3 ряда солей, т.к. кислотных остатков три:
А⁻³ — цитрат
НА⁻² — гидроцитрат
Н₂А⁻¹ — гидроцитрат
Соответственно, при взаимодействии железа с лимонкой теоретически могут быть получены три разные соли:
Fe + 2Н₃А = Н₂ + Fe(Н₂А)₂ ______ соотношение 1 моль Fe: 2 моль Н₃А
Fe + Н₃А = Н₂ + FeНА __________ соотношение 1 моль Fe: 1 моль Н₃А
3Fe + 2Н₃А = 3Н₂ + Fe₃А₂ _______соотношение 1 моль Fe: 2/3 моль Н₃А
Итого — 3 возможных продукта растворения гвоздей.
Я приготовил для смешивания 1 моль Fe и р-р, содержащий 1/4 моль Н₃А. В надежде на то, что бы:
а) получить только средний цитрат Fe₃А₂, а не смесь Fe(Н₂А)₂ + FeНА + Fe₃А₂
б) лимонную кислоту задействовать по максимуму — растворить как можно больше железа при при одном и том же расходе лимонной к-ты. В нынешней «природе» значительно проще найти некую железяку (подходят любые, в т.ч. и частично ржавые), чем надыбать достаточное количество всякой-разной сильно кислой кислятины.
***Примечание. На самом деле, электролиты можно строго разделить только на сильные и слабые. Сильные диссоциируют в р-рах полностью и необратимо. Слабые — обратимо и, как правило, не особо охотно. Т.н. электролиты «средней силы» — это тоже слабые, но по сравнению с остальными слабыми, они диссоциируют не настолько плохо и тяжело. Вот такое бестолковое определение. Но по сути — единственно верное.
2) Железо при взаимодействии с кислотами-неокислителями всегда сначала переходит в ионы Fe⁺² и лишь потом может неспеша доокисляться под действием кислорода воздуха во влажной среде или растворе Fe⁺²→Fe⁺³. А значит, некоторая часть цитратов двухвалентного железа могут постепенно превратиться в цитраты трехвалентного железа:
Fe(Н₂А)₂ → Fe(Н₂А)₃
FeНА → Fe₂(НА)₃
Fe₃А₂ → FeА
Добавилось еще 3 соли. Теперь стало 6 возможных продуктов растворения гвоздей.
3) Теперь про силу кислоты, смотрим табличку с константами диссоциации по трем ступеням:
 Для сравнения нам понадобятся константы всем хорошо известных кислот: фосфорной (средней силы) уксусной (слабая) и угольной (совсем слабая)
Для сравнения нам понадобятся константы всем хорошо известных кислот: фосфорной (средней силы) уксусной (слабая) и угольной (совсем слабая)
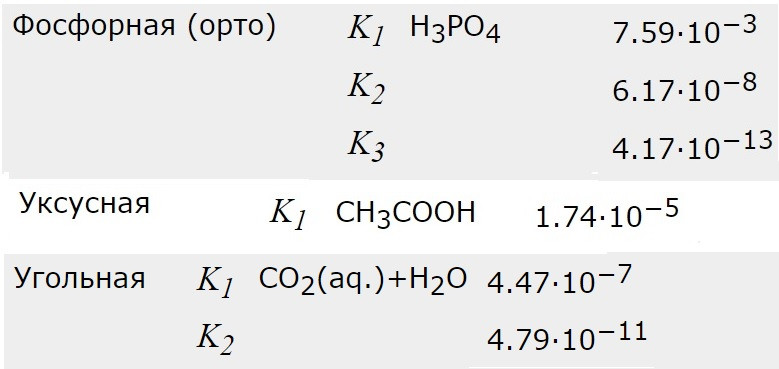 Так вот, лимонная к-та имеет среднюю силу при диссоциации по 1 ступени. Она заметно сильнее уксусной. Несколько слабее фосфорной, которая тоже считается средней силы.
Так вот, лимонная к-та имеет среднюю силу при диссоциации по 1 ступени. Она заметно сильнее уксусной. Несколько слабее фосфорной, которая тоже считается средней силы.
По 2 ступени лимонная к-та намного сильнее фосфорной (по 2 ступени) и одинакова с уксусной.
По 3 ступени лимонная к-та неизмеримо сильнее фосфорной (по 3 ступени) и несколько слабее уксусной. Аналогична угольной по 1 ступени. А газировку уже можно пить.;)
4) Вы думаете, это все? Отнюдь. Лимонка приготовил еще один «сюрприз».
В водном растворе она образует комплексы с ионами кальция, магния, меди, железа и другими металлами.
А значит, ситуация с количеством продуктов растворения гвоздей и соотношением их в растворе становится еще менее понятной.
Вы думаете, теперь уже все?;) Ан нет.
По поводу комплексообразования у меня есть еще 2 новости. И обе плохие.
а) Те самые комплексы хелатные, а они в случае органических лигандов наиболее устойчивые (хлорофилл и гемоглобин — тоже хелатные комплексы с ионами Mg⁺² и Fe⁺²). То есть, часть солей, рассмотренных выше, могут оказаться не обычными солями, а комплексными соединениями, неохотно отдающими ионы Fe⁺² и Fe⁺³ в раствор. Комплексы танинов с Fe⁺² и Fe⁺³ тоже могут оказаться хелатными. И если они окажутся более устойчивые, чем цитратные, то да, железо постепенно перейдет в чернильный пигмент. А если нет, то…
5) Молекулы, не провзаимодействовавшие с железом могут присоединиться к цитратным комплексам с образованием дополнительных связей. О такой возможности упоминается даже в Вики. И не известно, захотят ли они потом вступать в реакции с железом. Значит, теоретически возможен пустой расход лимонки.
Вот теперь все.
1) Лимонная к-та считается трехосновной и «средней» силы***.
Раз она трехосновная, ее брутто-формулу можно написать как Н₃(C₆H₅O₇), или Н₃А (принято в неорганической химии), или АН₃ (принято в органической химии). Она может давать 3 ряда солей, т.к. кислотных остатков три:
А⁻³ — цитрат
НА⁻² — гидроцитрат
Н₂А⁻¹ — гидроцитрат
Соответственно, при взаимодействии железа с лимонкой теоретически могут быть получены три разные соли:
Fe + 2Н₃А = Н₂ + Fe(Н₂А)₂ ______ соотношение 1 моль Fe: 2 моль Н₃А
Fe + Н₃А = Н₂ + FeНА __________ соотношение 1 моль Fe: 1 моль Н₃А
3Fe + 2Н₃А = 3Н₂ + Fe₃А₂ _______соотношение 1 моль Fe: 2/3 моль Н₃А
Итого — 3 возможных продукта растворения гвоздей.
Я приготовил для смешивания 1 моль Fe и р-р, содержащий 1/4 моль Н₃А. В надежде на то, что бы:
а) получить только средний цитрат Fe₃А₂, а не смесь Fe(Н₂А)₂ + FeНА + Fe₃А₂
б) лимонную кислоту задействовать по максимуму — растворить как можно больше железа при при одном и том же расходе лимонной к-ты. В нынешней «природе» значительно проще найти некую железяку (подходят любые, в т.ч. и частично ржавые), чем надыбать достаточное количество всякой-разной сильно кислой кислятины.
***Примечание. На самом деле, электролиты можно строго разделить только на сильные и слабые. Сильные диссоциируют в р-рах полностью и необратимо. Слабые — обратимо и, как правило, не особо охотно. Т.н. электролиты «средней силы» — это тоже слабые, но по сравнению с остальными слабыми, они диссоциируют не настолько плохо и тяжело. Вот такое бестолковое определение. Но по сути — единственно верное.
2) Железо при взаимодействии с кислотами-неокислителями всегда сначала переходит в ионы Fe⁺² и лишь потом может неспеша доокисляться под действием кислорода воздуха во влажной среде или растворе Fe⁺²→Fe⁺³. А значит, некоторая часть цитратов двухвалентного железа могут постепенно превратиться в цитраты трехвалентного железа:
Fe(Н₂А)₂ → Fe(Н₂А)₃
FeНА → Fe₂(НА)₃
Fe₃А₂ → FeА
Добавилось еще 3 соли. Теперь стало 6 возможных продуктов растворения гвоздей.
3) Теперь про силу кислоты, смотрим табличку с константами диссоциации по трем ступеням:
 Для сравнения нам понадобятся константы всем хорошо известных кислот: фосфорной (средней силы) уксусной (слабая) и угольной (совсем слабая)
Для сравнения нам понадобятся константы всем хорошо известных кислот: фосфорной (средней силы) уксусной (слабая) и угольной (совсем слабая)  Так вот, лимонная к-та имеет среднюю силу при диссоциации по 1 ступени. Она заметно сильнее уксусной. Несколько слабее фосфорной, которая тоже считается средней силы.
Так вот, лимонная к-та имеет среднюю силу при диссоциации по 1 ступени. Она заметно сильнее уксусной. Несколько слабее фосфорной, которая тоже считается средней силы.По 2 ступени лимонная к-та намного сильнее фосфорной (по 2 ступени) и одинакова с уксусной.
По 3 ступени лимонная к-та неизмеримо сильнее фосфорной (по 3 ступени) и несколько слабее уксусной. Аналогична угольной по 1 ступени. А газировку уже можно пить.;)
4) Вы думаете, это все? Отнюдь. Лимонка приготовил еще один «сюрприз».
В водном растворе она образует комплексы с ионами кальция, магния, меди, железа и другими металлами.
А значит, ситуация с количеством продуктов растворения гвоздей и соотношением их в растворе становится еще менее понятной.
Вы думаете, теперь уже все?;) Ан нет.
По поводу комплексообразования у меня есть еще 2 новости. И обе плохие.
а) Те самые комплексы хелатные, а они в случае органических лигандов наиболее устойчивые (хлорофилл и гемоглобин — тоже хелатные комплексы с ионами Mg⁺² и Fe⁺²). То есть, часть солей, рассмотренных выше, могут оказаться не обычными солями, а комплексными соединениями, неохотно отдающими ионы Fe⁺² и Fe⁺³ в раствор. Комплексы танинов с Fe⁺² и Fe⁺³ тоже могут оказаться хелатными. И если они окажутся более устойчивые, чем цитратные, то да, железо постепенно перейдет в чернильный пигмент. А если нет, то…
5) Молекулы, не провзаимодействовавшие с железом могут присоединиться к цитратным комплексам с образованием дополнительных связей. О такой возможности упоминается даже в Вики. И не известно, захотят ли они потом вступать в реакции с железом. Значит, теоретически возможен пустой расход лимонки.
Вот теперь все.
Самый важный момент (из спрятанного под спойлером).
Как оказалось в дальнейшем, образование хелатных комплексов Fe⁺² и Fe⁺³ с цитрат-ионами и целыми молекулами лимонной кислоты реально сказывается на интенсивности окраски чернил. Они ее ослабляют в разной степени (в зависимости от состава смеси).
После переноса гвоздей в кислый раствор водород пошел не сразу, индукционный период ~5-10 мин. Потом стали выделяться мелкие пузырьки. Довольно активно.
Через 15-16 часов:
 Водород выделяется с постоянной скоростью. Не особо бурно, но стабильно. На фото получилось не очень — пока возился с баллоном, пузырьки со стенок убежали. Гвозди стали «вороненые», что не было неожиданностью (воронение Оппинеля в р-ре лимонки). Раствор приобрел слабо желтую окраску. Баллон закрыт не плотно, что бы не разорвало. Если полностью открутить крышку и понюхать — чувствуется запах как в слесарной мастерской.
Водород выделяется с постоянной скоростью. Не особо бурно, но стабильно. На фото получилось не очень — пока возился с баллоном, пузырьки со стенок убежали. Гвозди стали «вороненые», что не было неожиданностью (воронение Оппинеля в р-ре лимонки). Раствор приобрел слабо желтую окраску. Баллон закрыт не плотно, что бы не разорвало. Если полностью открутить крышку и понюхать — чувствуется запах как в слесарной мастерской.3.1.2. Взаимодействие железа с 9% уксусом, получение ацетата железа
Если кратко — водород выделяется менее активно, чем в 8.3% р-ре лимонки первые трое суток. При этом молярная концентрация лимонной к-ы в 3 раза меньше (182/60=3). Но это на интенсивность взаимодействия не влияет, т.к. при концентрациях >0.1% подавляющее кол-во молекул несильных к-т пребывают в недиссоциированном виде и не влияют на pH р-ра.
Дополнительная информация
Я сделал расчеты в HySS2009 и прикинул pH путем макания универсальной индикаторной бумаги в исходные растворы: уксус pH~3, лимонка pH~2
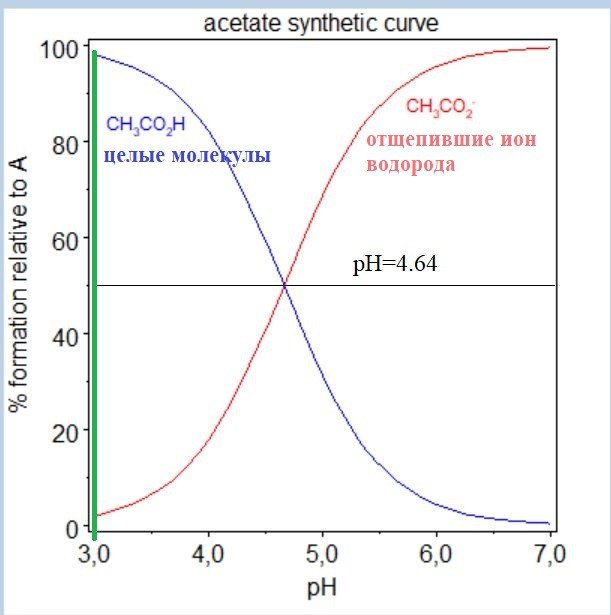


Зато лимонка примерно в 6.5 раз сильнее уксусной — нужно посчитать отношение Кд двух кислот по первой ступени (см. выше под спойлером «Особенности лимонной кислоты») и извлечь квадратный корень. А это приводит к сдвигу pH в кислую сторону почти на единицу:
pH = — lg(6.5) = 0.8
На фото — гвозди в уксусной к-те (через сутки) и лимонной к-те (на 6 день).
 Уксусная к-та совершенно свежая, не выдохшаяся, куплена в «Пятерочке» накануне. Герметичная емкость была вскрыта за пару минут до начала приготовления раствора.
Уксусная к-та совершенно свежая, не выдохшаяся, куплена в «Пятерочке» накануне. Герметичная емкость была вскрыта за пару минут до начала приготовления раствора.Остаток чистых, отмытых гвоздей потянул 10.3 г. Это 0.184 моль Fe.
М(СН₃СООН) = 60.05 г/моль. А 0.184 моль СН₃СООН — это 11.05 г. Реакция идет по уравнению
Fe + 2СН₃СООН = Fe(СН₃СОО)₂ + H₂ __ соотношение 1 моль Fe: 2 моль СН₃СООН
Значит, для растворения 10.3 г чистого железа нужно как минимум 22.10 г СН₃СООН.
22.10 г СН₃СООН содержатся в 245.5 г уксуса (9%).
Что бы железо и здесь оказалось в огромном избытке я отмерил 107,9 г уксуса.
На этом фото — гвозди в уксусной к-те на 8 сутки (слева) и лимонной к-те на 13 день (справа). Взаимодействие идет вяло в обеих емкостях. Но в лимонной к-те до сих пор чуть заметнее. Наверное, просто гвоздей в 5 раз больше.
 Обратите внимание на цвет р-ра слева. Железо переходит в р-р в виде бесцветных ионов Fe⁺². Кислород воздуха медленно окисляет железо Fe⁺² + е⁻ = Fe⁺³. Ионы Fe⁺³ из различных солей окрашивают водные р-ры в цвета от желтого до красно-бурого. Здесь — нечто желто-розоватое. Ибо ацетат железа(III) суть красно-коричневые кристаллы. Совсем слабые р-ры ацетата железа(III) желтоватые, при увеличении концентрации — постепенно розовеют, потом краснеют.
Обратите внимание на цвет р-ра слева. Железо переходит в р-р в виде бесцветных ионов Fe⁺². Кислород воздуха медленно окисляет железо Fe⁺² + е⁻ = Fe⁺³. Ионы Fe⁺³ из различных солей окрашивают водные р-ры в цвета от желтого до красно-бурого. Здесь — нечто желто-розоватое. Ибо ацетат железа(III) суть красно-коричневые кристаллы. Совсем слабые р-ры ацетата железа(III) желтоватые, при увеличении концентрации — постепенно розовеют, потом краснеют.Наконец-то померил рН растворов универсальной индикаторной бумагой. Её теперь часто называют «лакмусовой», даже производители. С т.з. химии это совершенно неправильно, но для широких масс покупателей вполне допустимо. Ибо настоящая лакмусовая бумага не выпускается уже лет 40 (дорого и смысла в ней нет), а что такое «универсальная индикаторная» мало кто знает.
Шкала расшифровки сделана
 Сейчас в уксуснокислом р-ре рН~4-4.5, а в лимоннокислом р-ре рН~3.
Сейчас в уксуснокислом р-ре рН~4-4.5, а в лимоннокислом р-ре рН~3.Изначально было 3 и 2 соответственно.
Картинка на фото отличается от того, что я вижу живьем. Цветовые таблицы подгоняются под восприятие [среднестатистическим] человеческим глазом. А камера это дело фиксирует немного по-другому, даже если откалибровать ББ по серой карте.
Есть мнение, что кислоты почти полностью прореагировали, их концентрация понизилась примерно на 2 порядка. Дело в том, что 1 ед.рН — это изменение в концентрации:
— для сильной кислоты в 10 раз
— для слабой (уксусной, лимонной и др.) в 100 раз.
Если когда-нибудь напишу обзор про измерения рН, я этот момент подробно разжую.
3.2. Гуммиарабик
Удивительно, но камеди я не нашел. Ни вишневой, ни какой другой.
Во дворах нашего микрорайона растет ~20 косточковых деревьев: алыча и урюк. Но камеди нет.
У соседей на даче есть несколько вишневых деревьев. Но они целые-невредимые, без камеди.
Пришлось разориться и заказать 200 г гуммиарабика Gum Arabic Norevo за 520 руб (была скидка 100 руб). В других местах еще дороже. Если честно, я больше всего боялся, что подсунут декстрин, который намного дешевле и вообще некошерный. То, что пришло было жутко похоже на кукурузный декстрин — такой же бело-желтоватый порошок. Все декстрины получают нареванием некого крахмала до 200-250 град. Длинные полимерные цепи крахмала разваливаются на более короткие. В отличии от крахмалов декстрины хорошо растворимы воде, образуют клейкую гелеобразную массу. В прошлой жизни из крахмала, «прожаренного» на сковороде делали клей для обоев и окон. Держался он не долго, несколько лет, но зато практически ничего не стоил. И тараканы его любили кушать. Зато никакой синтетики, все природное, все натуральное…
Полез в и-нет и через 5 мин выяснил, что растворы всех декстринов дают положительную йодную пробу (посинение вплоть до почернения). И даже более чувствительны и йоду, чем исходные крахмалы. А р-ры всех камедей — нет. Насчет крахмалов/декстринов никто и не сомневался (окрашивание йодом — природоведение, 5 кл.). А про гуммиарабик и прочие подобные гумми (камеди) был не в курсе.
На фото слева в стопке чайная ложка моего гуммиарабика в 30 мл воды, а справа — разрезанная сырая картофелина. Туда и туда добавил по 2 жирные капли йода. Купленный гумми показал отсутствие даже следов крахмала, декстрина или чего-то подобного.
 Я даже не ожидал, что на поверхности разрезанной картошки окажется так много крахмала.:)
Я даже не ожидал, что на поверхности разрезанной картошки окажется так много крахмала.:)3.3. Вытяжки из галлов
Как уже было отмечено в 1 части обзора, сушеные галлы были куплены тут. Товар пришел в 2 зип-пакетах: 103 г (покупка) + 25 г (подарок от продавца). На фото справа — содержимое второго пакетика после измельчения.
 В пластиковые емкости были помещены 3 навески по 10 г измельченных галлов и залиты жидкостями для вытяжки, массой 200-210 г:
В пластиковые емкости были помещены 3 навески по 10 г измельченных галлов и залиты жидкостями для вытяжки, массой 200-210 г:— вода
— 9% р-р уксусной к-ты
— 9% р-р лимонной к-ты.
Это они через 4 часа экстрагирования
 Фото получилось не очень — плохое освещение. Поэтому словами:
Фото получилось не очень — плохое освещение. Поэтому словами:— водная вытяжка прозрачна, с ярким, насыщенным коричневым цветом,
— кислые вытяжки мутноваты и светлее.
Причем, такое состояние растворы приобрели почти сразу же, в течении первых 10-15 мин.
Это через 7 часов экстрагирования
 — водная вытяжка стала мутновата, окраска стала светлее,
— водная вытяжка стала мутновата, окраска стала светлее,— кислые вытяжки не изменились.
Через 48 часов экстрагирования. Но изменения произошли часов 10-12 назад. Просто дождался утра, поставил на подоконник, сделал положительную экспокоррекцию + подтянул в редакторе.

Без экспокоррекции и обработки

— водная вытяжка стала совсем мутной и почти непрозрачной, выпал светлый осадок,
— кислые вытяжки стали прозрачными, выпало немного осадков (лимоннокислая вытяжка несколько светлее уксусной).
Такое впечатление, что в нейтральном р-ре поселились дрожжи и пошло что-то типа брожения-разложения. Так оно и оказалось.
Забегая немного вперед — водная вытяжка через 9 суток:
 Раствор мутный, рН=5. На дне — дрожжевой осадок. На поверхности появилась плесень (споровые тела дрожжей-?). Все идет «по плану», даже с опережением: плесень д.б. появиться через несколько недель, а тут — через одну. Если, конечно, рецепт от Э. Линдквиста переведен правильно — он был в первой части обзора, но что бы не искать повторю:
Раствор мутный, рН=5. На дне — дрожжевой осадок. На поверхности появилась плесень (споровые тела дрожжей-?). Все идет «по плану», даже с опережением: плесень д.б. появиться через несколько недель, а тут — через одну. Если, конечно, рецепт от Э. Линдквиста переведен правильно — он был в первой части обзора, но что бы не искать повторю:Железо-галловые чернила с ферментацией
— Галлы, 5 г
— Сульфат железа, 1 г
— Гуммиарабик, 1 г
— Вода, 200 г
Перемелите галлы в пудру и замочите в половине воды. Через несколько недель верхушка покроется плесенью. Снимите плесень и пролейте жидкость сквозь фильтр. Растворите гуммиарабик в небольшом количестве воды и добавьте к жидкости. Растворите сульфат железа в воде и добавьте к вашей жидкости. Чтобы предотвратить образование плесени, добавьте 1 г карболовой кислоты.
Примечания (мои):
1. Я так понимаю, речь идет о сухих галлах — их можно перемолоть в порошок.
2. Содержание танинов в сухих галлах гуляет от 40 до 80%, поэтому 5 г весьма условны.
3. Скорее всего, речь идет не о сульфате железа (он гигроскопичный и в продаже нет), а о «кристаллическом» сульфате железа = железный купорос = FeSO₄·7H₂О. В железном купоросе FeSO₄ только 55%, но художники в таких тонкостях не разбираются.
4. Карболовой кислотой химики называют фенол. В быту и в медицине «каболкой» называют асептические р-ры с концентрацией фенола 1-5%. Максимальная растворимость фенола в воде 6 г на 100 г H₂О. Древние изготовители чернил про фенол и прочую «химию» были ни сном ни духом и применяли что-то другое. Всегда разное. К примеру, часто упоминается, что использовались гвоздика (и корица-?). Но что использовать в походных условиях — я пока ума не дам…
— Сульфат железа, 1 г
— Гуммиарабик, 1 г
— Вода, 200 г
Перемелите галлы в пудру и замочите в половине воды. Через несколько недель верхушка покроется плесенью. Снимите плесень и пролейте жидкость сквозь фильтр. Растворите гуммиарабик в небольшом количестве воды и добавьте к жидкости. Растворите сульфат железа в воде и добавьте к вашей жидкости. Чтобы предотвратить образование плесени, добавьте 1 г карболовой кислоты.
Примечания (мои):
1. Я так понимаю, речь идет о сухих галлах — их можно перемолоть в порошок.
2. Содержание танинов в сухих галлах гуляет от 40 до 80%, поэтому 5 г весьма условны.
3. Скорее всего, речь идет не о сульфате железа (он гигроскопичный и в продаже нет), а о «кристаллическом» сульфате железа = железный купорос = FeSO₄·7H₂О. В железном купоросе FeSO₄ только 55%, но художники в таких тонкостях не разбираются.
4. Карболовой кислотой химики называют фенол. В быту и в медицине «каболкой» называют асептические р-ры с концентрацией фенола 1-5%. Максимальная растворимость фенола в воде 6 г на 100 г H₂О. Древние изготовители чернил про фенол и прочую «химию» были ни сном ни духом и применяли что-то другое. Всегда разное. К примеру, часто упоминается, что использовались гвоздика (и корица-?). Но что использовать в походных условиях — я пока ума не дам…
А кислые вытяжки давно не меняются. Прозрачные, цвет коньячный (см. выше).
3.4. Первые чернила из галлов: 3 разные вытяжки + FeSO₄ + гумми
Вернемся немного назад.
Итак, прошло ровно 3 суток после замеса. Состояние вытяжек такое же, как после 48 часов (см. выше). Если верить интернетам, рекомендуемое время подготовки вытяжек (без нагревания и без ферментации) 7-10 суток. Тем не менее, решил сделать пробный замес чернил. Отобраны пробы вытяжек по ~5 мл.
 Слева — насыщенный р-р железного купороса, приготовленный из расчета 26.3г/100г(H₂О). Взято из «Краткого справочника химика», 1971г.
Слева — насыщенный р-р железного купороса, приготовленный из расчета 26.3г/100г(H₂О). Взято из «Краткого справочника химика», 1971г. Прозрачные зеленоватые кристаллы купороса при растворении дали грязно-желтый мутный раствор. Наглядная иллюстрация к школьной теме «Гидролиз солей». Я знаю, как можно было избежать помутнения, нужно было заменить «классический» купорос FeSO₄·7H₂О на железо-аммонийные квасцы. Но во всех источниках фигурирует исключительно FeSO₄·7H₂О, а значит, помутнение (образование основных солей) на конечный результат не влияет.
Прозрачные зеленоватые кристаллы купороса при растворении дали грязно-желтый мутный раствор. Наглядная иллюстрация к школьной теме «Гидролиз солей». Я знаю, как можно было избежать помутнения, нужно было заменить «классический» купорос FeSO₄·7H₂О на железо-аммонийные квасцы. Но во всех источниках фигурирует исключительно FeSO₄·7H₂О, а значит, помутнение (образование основных солей) на конечный результат не влияет.Пока без клея
Шприцом внес по 0.5 мл р-ра купороса в каждый из пузырьков.
 Как и ожидалось, лимонка связывает ионы железа в комплексы и мешает образованию комплексов с танинами. Решил добавить еще по 0.5 мл р-ра купороса. Похоже, не зря.
Как и ожидалось, лимонка связывает ионы железа в комплексы и мешает образованию комплексов с танинами. Решил добавить еще по 0.5 мл р-ра купороса. Похоже, не зря. Результат (самопальная бамбуковая ручка):
Результат (самопальная бамбуковая ручка): Очень хорошо выражен эффект «проявки изображения»: вначале пишешь светло-серой водичкой (в случае лимонки — светло-желтой), а потом прямо на глазах написанное начинает темнеть.
Очень хорошо выражен эффект «проявки изображения»: вначале пишешь светло-серой водичкой (в случае лимонки — светло-желтой), а потом прямо на глазах написанное начинает темнеть.Теперь с гуммиарабиком
В каждый пузырек добавил по 0.5 г гуммиарабика. В водной и уксуснокислой вытяжках гумми растворился при помешивании в течении 5-7 мин. А в лимоннокислой — растворялся не так охотно.
 Решил подождать 20-30 мин, что бы смеси настоялись. И от скуки окунул индикаторные бумажки в чернила. Лимоннокислые чернила показали явно кислую среду (рН~2). А остальные похвастались своим красителем.
Решил подождать 20-30 мин, что бы смеси настоялись. И от скуки окунул индикаторные бумажки в чернила. Лимоннокислые чернила показали явно кислую среду (рН~2). А остальные похвастались своим красителем. Минут через 20-25 гумми таки растворился в лимоннокислой вытяжке.
Минут через 20-25 гумми таки растворился в лимоннокислой вытяжке. Лимоннокислые чернила почему-то плохо смачивали металлическое перо, приходилось писать по 2 буквы между маканиями.
Лимоннокислые чернила почему-то плохо смачивали металлическое перо, приходилось писать по 2 буквы между маканиями.Для дальнейших опытов мне нужно было освободить 2 пузырька. Поэтому чернила на лимонке я просто вылил. А содержимое двух остальных пузырьков слил в один. Далее это будет называться как «смесь вытяжек».
3.5. Замена №1: FeSO₄ ацетат Fe из гвоздей
На момент проведения эксперимента гвозди настаивались в уксусе 15 суток.
Делалось по схеме, изложенной выше с небольшими изменениями:
— насыщенный р-р FeSO₄ (1 мл) заменен на 4 мл р-р ацетата Fe из гвоздей (шприц)
— вместо 0.5 г сухого гуммиарабика добавлялся 1 г.
После введения 4 мл р-ра ацетата Fe в пробы по 5 мл:
 Замес гуммиарабика (низ ватных палочек со второй ваткой отрезан)
Замес гуммиарабика (низ ватных палочек со второй ваткой отрезан) Результат:
Результат:
3.6. Замена №2: FeSO₄ цитрат Fe из гвоздей
На момент проведения эксперимента гвозди настаивались в р-ре лимонной к-ты 20 суток. Схема проведения и дозировки — точно такие же, как в случае ацетата:
— вытяжка
— 4 мл р-р цитрата Fe из гвоздей (шприц)
— 1 г сухого гуммиарабика.
Введение цитрата не дало такого насыщенной сине-черной окраски в водной и уксусной вытяжках, как в предыдущем случае
 Результат:
Результат:
Через 12 суток. Внешне вытяжки практически не изменились. Ну, разве что появилась плесень (см. выше). Схема изготовления чернил прежняя.

4. Кора дуба как замена галлов (источник танинов)
Про кору дуба как источник дубильных в-в
Дубовая кора, сравнительно с другими дубильными материалами, употребляется в наибольшем количестве. Кора всех видов дуба, произрастающих в Европе и в Америке, содержит много дубильных веществ. В Западной Европе употребляют преимущественно кору дубов черешчатого (Quercus robur), скального (Quercus petraea) и австрийского (Quercus cerris), иногда также пробкового (Quercus suber). Наибольшее количество дубильных веществ содержится в коре дуба в период наиболее сильного роста дерева; поэтому для получения лучших дубильных материалов деревья срубают в возрасте от 15 до 30 лет. Снятие коры производится обыкновенно в июне, во время сильного движения сока, так как тогда она легче всего отделяется от ствола; для этого на стволе делают горизонтальные надрезы на расстояниях около 1 м по высоте, затем несколько вертикальных надрезов, и кору снимают полосами; снятую кору высушивают на воздухе в тени. «Зеркальная» кора с деревьев до 20 лет имеет блестящую серебристую или серую поверхность, бывает гладкая и сморщенная, с трещинами, нередко с пятнами, имеет сильно вяжущий вкус. Содержание дубильного вещества в зеркальной коре достигает 16 и даже 20 %, но в среднем 12 %; обыкновенная дубовая кора содержит 4—10 % дубильного вещества. Содержание дубильного вещества в коре зависит не только от возраста дерева, но неравномерно распределяется в коре отдельных деревьев: в коре у основания дерева содержится больше дубильного вещества, в верхних частях меньше. Вообще содержание дубильного вещества в дубовой коре подвержено большим колебаниям. При хранении сухой дубовой коры на воздухе содержание в ней дубильного вещества не изменяется; напротив, во влажной коре оно значительно уменьшается.
Ежегодные заготовки дубовой коры в СССР превышали 500 т
Ежегодные заготовки дубовой коры в СССР превышали 500 т
Альтернативы - в смысле коры других бросовых деревьев
Ивовая кора
Ивовая кора от различных видов ивы (козьей (Salix caprea), пепельной (Salix cinerea), трёхтычинковой (Salix triandra), чернеющей (Salix myrsinifolia)) применяется особенно часто на кожевенных заводах, а для некоторых сортов кожевенного товара даже предпочитается дубовой. Содержание дубильных веществ в ивовой коре изменяется в широких пределах, от 2 до 12 (даже 16) %.
В XIX веке в России употребляли для дубления кору многих древовидных ив. В Германии применяли также кору ивы прутовидной (Salix viminalis), но она содержит мало дубильных веществ (1,72—4,71 %).
Прочая древесина
Еловая кора представляет немаловажный и самый дешёвый материал. Дубильное вещество её обходится вдвое дешевле, нежели при употреблении дубовой коры. Еловая кора содержит 7—13 % дубильного вещества. Меньшее значение, нежели указанные сорта коры, имеют: берёзовая кора (от берёзы повислой (Betula pendula)) с содержанием дубильного вещества до 5,5 %, кора различных видов ольхи с содержанием дубильного вещества от 7 до 12,5 %, кора вяза, лиственницы и др.
Ивовая кора от различных видов ивы (козьей (Salix caprea), пепельной (Salix cinerea), трёхтычинковой (Salix triandra), чернеющей (Salix myrsinifolia)) применяется особенно часто на кожевенных заводах, а для некоторых сортов кожевенного товара даже предпочитается дубовой. Содержание дубильных веществ в ивовой коре изменяется в широких пределах, от 2 до 12 (даже 16) %.
В XIX веке в России употребляли для дубления кору многих древовидных ив. В Германии применяли также кору ивы прутовидной (Salix viminalis), но она содержит мало дубильных веществ (1,72—4,71 %).
Прочая древесина
Еловая кора представляет немаловажный и самый дешёвый материал. Дубильное вещество её обходится вдвое дешевле, нежели при употреблении дубовой коры. Еловая кора содержит 7—13 % дубильного вещества. Меньшее значение, нежели указанные сорта коры, имеют: берёзовая кора (от берёзы повислой (Betula pendula)) с содержанием дубильного вещества до 5,5 %, кора различных видов ольхи с содержанием дубильного вещества от 7 до 12,5 %, кора вяза, лиственницы и др.
4.1. Кора дуба + уксус + гвозди
По классике, смешивание основных компонентов натуральных чернил (вытяжка танинов + р-р с ионами железа + клей) происходит в момент их приготовления. Но я решил попробовать получить окрашенный раствор, содержащий комплексы полифенолы + ионы железа в один этап. А процесс приготовления продукта свести к простому добавлению гуммиарабика.
Собственно, идея
— вода вытягивает танины из источника (дубовая кора и т.п.)
— параллельно с этим гвозди в кислоте дают ионы железа: Fe + 2H⁺ = Fe⁺² + H₂
— ионы железа дают с танинами в р-ре комплексы Fe⁺²•полифенолы.
Основной проблемой этой схемы является принципиальная возможность окисления ионов железа Fe⁺² до Fe⁺³ атмосферным кислородом в кислой среде с образованием плохо растворимых комплексов Fe⁺³•полифенолы. Они как правило черные (что хорошо), но не пойдут в бумагу (что плохо) и общая концентрация их в смеси с гумми неведома. Процесс окисления Fe⁺² до Fe⁺³ не шибко шустрый, но и гвозди в кислоте вымачиваются продолговато — сутками.
Была отмеряна навеска пиленной дубовой коры 10 г (0.8 г — вес бумажки). Каким образом та кора была получена рассказано в первой части статьи.
 Потом было добавлено 30 г отмытых гвоздей и 220 г уксуса 9%. Гвозди опять в огромном избытке (трехкратном). Это для того, что бы увеличить площадь поверхности соприкосновения металла с кислым р-ром и реакция шла повеселее.
Потом было добавлено 30 г отмытых гвоздей и 220 г уксуса 9%. Гвозди опять в огромном избытке (трехкратном). Это для того, что бы увеличить площадь поверхности соприкосновения металла с кислым р-ром и реакция шла повеселее.Через 30 мин после замеса:

Через 25 часов после замеса:

Экспокоррекция +2 EV
Почему-то все ушло в фиолет


Налил в рюмку 10-15 мл и стал делать пробы на бумаге, периодически добавляя гуммиарабик
 Окраска пока блекловатая, а с гумми тоже надо не перебарщивать.
Окраска пока блекловатая, а с гумми тоже надо не перебарщивать.Интересный момент, в процессе добавления клея чернила темнели, а в конце стали черными и непрозрачными.
 Но это не усилило окраску написанного, скорее наоборот. Мне кажется, причиной потемнения являлись многократные интенсивные перемешивания после введения очередной дозы клея. При этом в раствор попадало немало воздуха и железо окислялось Fe⁺² + е⁻ = Fe⁺³. Комплексы Fe⁺² с танинами водорастворимы и светлее, а комплексы Fe⁺³ практ. нерастворимы и чисто черные. Получается разряженная взвесь мелких черных частиц в желеобразном б/ц р-ре, дающая блеклую писанину.
Но это не усилило окраску написанного, скорее наоборот. Мне кажется, причиной потемнения являлись многократные интенсивные перемешивания после введения очередной дозы клея. При этом в раствор попадало немало воздуха и железо окислялось Fe⁺² + е⁻ = Fe⁺³. Комплексы Fe⁺² с танинами водорастворимы и светлее, а комплексы Fe⁺³ практ. нерастворимы и чисто черные. Получается разряженная взвесь мелких черных частиц в желеобразном б/ц р-ре, дающая блеклую писанину.Через 3 суток. Черная окраску р-р приобрел еще сутки назад. Причем, он не прозрачен даже после отбора пробы в рюмку.
 Что без клея, что с гумми (3 г) — ничего толком пока не получилось
Что без клея, что с гумми (3 г) — ничего толком пока не получилось
Через 13 суток.

4.2. (Кора дуба + вода) → отваривание 30 мин
Собственно, стало понятно, в вытяжках дуба не хватает дубильных веществ (танинов). Потому и писанина блекловата. А как извлекают дубильные в-ва из коры? Например, для количественного определения оных? Думаете от балды — кто во что горазд? Ан нет, оказывается у фармацевтов существуют свои ГОСТы. Они собраны в одну кучу, которая называются Государственная фармакопея. Аналогичная штука есть и в сопредельных странах, например у белорусов.
В Государственную фармакопею XIV РФ включено 8 танин-содержащих видов лекарственного растительного сырья
8 танин-содержащих видов лекарственного растительного сырья:
— бадана толстолистного корневища (Bergeniae crassifoliae rhizomata),
— дуба кора (Quercus cortex),
-змеевика корневища (Bistortae rhizomata),
— калины обыкновенной кора (Viburni opuli cortex),
— кровохлебки лекарственной корневища с корнями (Sanguisorbae officinalis rhizomata cum radicibus),
— лапчатки прямостоячей корневища (Potentillae erectae rhizomata),
— ольхи соплодия (Alni fructus),
— черемухи обыкновенной плоды (Padi avii fructus).
Еще в двух видах сырья:
— аира обыкновенного корневища (Acori calami rhizomata)
— зверобоя трава (Hyperici herba)
проводят идентификацию данной группы соединений.
— бадана толстолистного корневища (Bergeniae crassifoliae rhizomata),
— дуба кора (Quercus cortex),
-змеевика корневища (Bistortae rhizomata),
— калины обыкновенной кора (Viburni opuli cortex),
— кровохлебки лекарственной корневища с корнями (Sanguisorbae officinalis rhizomata cum radicibus),
— лапчатки прямостоячей корневища (Potentillae erectae rhizomata),
— ольхи соплодия (Alni fructus),
— черемухи обыкновенной плоды (Padi avii fructus).
Еще в двух видах сырья:
— аира обыкновенного корневища (Acori calami rhizomata)
— зверобоя трава (Hyperici herba)
проводят идентификацию данной группы соединений.
Так вот, находим ОФС.1.5.3.0008.15 «Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах» и читаем
 Понятно, что 2 г на 250 мл воды — это для удобства проведения количественного анализа навески. Для чернил более концентрированный р-р будет поинтереснее. Но все по порядку.
Понятно, что 2 г на 250 мл воды — это для удобства проведения количественного анализа навески. Для чернил более концентрированный р-р будет поинтереснее. Но все по порядку.Отмерил 10 г коры, поместил в 400 мл воды в аутентичной кружке из люминя.
 Довел до кипения, кипятил ~30 мин без крышки на малом огне. И пару раз подливал горячей воды, т.к. активно выкипало (наверное зря, но хотелось экстрагировать по максимуму). Потом дал остыть и профильтровал через туалетную бумагу (зачем — не знаю, в фарме — фильтруют).
Довел до кипения, кипятил ~30 мин без крышки на малом огне. И пару раз подливал горячей воды, т.к. активно выкипало (наверное зря, но хотелось экстрагировать по максимуму). Потом дал остыть и профильтровал через туалетную бумагу (зачем — не знаю, в фарме — фильтруют). Что получилось:
Что получилось: В левой рюмке — отвар без всего, в правой — с 1 г железного купороса и 1 г гуммиарабика. Запах приятный — отвар пахнет даже не деревяшками, а древесным соком (типа березового или кленового).
В левой рюмке — отвар без всего, в правой — с 1 г железного купороса и 1 г гуммиарабика. Запах приятный — отвар пахнет даже не деревяшками, а древесным соком (типа березового или кленового).  Писанина после проявления (10 мин)
Писанина после проявления (10 мин) Мда, блекловато будет.
Мда, блекловато будет.Решил увеличить концентрацию танинов путем выпаривания. В той же кружке на малом огне уменьшил массу р-ра ровно(!) на 60%, если точнее — на 59,7%. Только не спрашивайте, как такое возможно. Видать, на втором месяце телодвижений в сторону достижения намеченной цели пришло-таки мастерство. Нетрудно посчитать: концентрация растворенного в отваре увеличилась в 2.5 раза.
Результаты с двумя разными источниками ионов железа:
 Вроде, получилось более-менее сносно. Как делать отвар ольховых «шишек» я теперь представляю.
Вроде, получилось более-менее сносно. Как делать отвар ольховых «шишек» я теперь представляю.Кстати, во втором случае (ацетат из гвоздей) написанное под некоторыми углами имеет благородный бронзовый отлив. На фото не видно. Это, конечно, не лухари из того обзора, но все же. Интересно, через неделю-месяц-год хранения эта фича не исчезнет?
4.3. (Кора дуба + уксус + гвозди) → удаление воды (увеличение концентрации)
Через 13 суток настаивания остатки реакционной смеси (127 г) аккуратно выпарил на минимальном огне газовой конфорки до 25 г. Увеличение концентрации — в 5 раз.
Если бы жена с дочкой не уехали в командировку на неделю, то я бы ничего подобного не сделал. Ибо вытяжки на кухне нет, а уксус пёр по всей квартире — мама не горюй.

Те же буквы через 1 сутки

Получилось вроде как читабельно.
5. Соплодия ольхи как замена галлов (источник танинов)
5.1. Соплодия («шишки») ольхи + уксус + гвозди. Альтернатива: соплодия ольхи + вода
Вытяжка №1
Все делалось точно также как в случае коры дуба в уксусе с гвоздями. Для корректного сравнения. Рецептура абсолютно такая же:
10 г соплодий
30 г отмытых гвоздей
220 г уксуса 9%
Вытяжка №2
20 г соплодий
380 г водопроводной воды
Соплодия выглядят как малюсенькие «шишки», часто используются в новогодних поделках:

Через 2 часа после замесов:

Через 3 суток.

 Диагноз понятен — надо и здесь делать вытяжку при кипячении.
Диагноз понятен — надо и здесь делать вытяжку при кипячении.5.2. (Соплодия ольхи + уксус + гвозди) → удаление воды (увеличение концентрации)
Все тоже самое, как в случае коры и гвоздей в уксусе. 135 г → 33 г. Увеличение концентрации — в 4 раза.
 По сравнению с (кора+уксус+гвозди) получилось несколько более блекло. Возможные причины:
По сравнению с (кора+уксус+гвозди) получилось несколько более блекло. Возможные причины:— отмачивание в уксусе с гвоздями 10 сут., а не 13 [не важно]
— концентрирование вытяжки 4х, а не 5х [не существенно]
— концентрация танинов в данных соплодиях несколько меньше, чем в сабжевой стружке дубовой коры. [а вот это наиболее вероятно]
 Но в конечном итоге — вполне себе вменяемо и читаемо. И это — главное.
Но в конечном итоге — вполне себе вменяемо и читаемо. И это — главное.~~~~~~~~~~~~~~~~~~~~~~~
~~~~~~~~~~~~~~~~~~~~~~~
ИТОГО: задачи обзора в целом выполнены. Правда, не всегда все шло по плану. Но такое для поисковых работ — обычное дело.
~~~~~~~~~~~~~~~~~~~~~~~
~~~~~~~~~~~~~~~~~~~~~~~
Краткие выводы и заключение
1. Основная проблема изготовления железо-таниновых чернил из подручных материалов — это длительность процесса получения ионов железа в псевдо-походных («выжывальщецких») условиях. Настаивание гвоздей и других мелких железок в кислых растворах желательно проводить не менее 3-4 суток. Потом интенсивность взаимодействия снижается настолько, что ждать далее — скорее всего бессмысленно.
2. Ацетаты в целом предпочтительнее более сложных по строению и хим. свойствам солей органических кислот (цитратов и др.). Уксус-содержащее сырье в принципе можно получить в ходе уксуснокислого брожения всего сахар-содержащего в воде. Начиная с тертого сахарного тростника и заканчивая медом диких пчел. [шутка юмора]
3. При наличии дубовых галлов, чернила получаются без проблем. Любым способом. Можно длительным вытягиванием водой или кислым раствором. В качестве кислого р-ра уксус предпочтительнее лимонной кислоты.
Можно по-быстрому — кипячением галлов в воде или кислом р-ре.
Думаю, можно сразу же замачивать галлы с гвоздями в кислых р-рах. При этом выпаривать в конце не обязательно.
Кстати, галлы бывают не только дубовые. Но высокое содержание в них танинов мало предсказуемо.
4. Готовить вытяжки из дубовой коры и соплодий ольхи путем длительного (многосуточного) вымачивания в воде бессмысленно — концентрация танинов маловата. Все равно потом нужно кипячение с упариванием.
Оптимальным способом является:
— замес: природный источник танинов (любой) + кислый раствор (любой) + железяки с развитой поверхностью (какие найдете),
— выдержка от 3 суток и более (пока от железяк идут пузыри в замесе),
— максимально возможное выпаривание реакционной смеси,
— после охлаждения: добавление клея (типа камеди или живицы, возможно использование декстрина из крахмал-содержащих материалов) — не обязательно, но весьма желательно (иначе — скорее всего будет расплывадзэ на пишущей поверхности).
5. Думаю, что вместо дубовой коры и соплодий ольхи можно и нужно попробовать использовать обычный зверобой. В сухой траве зверобоя содержится 8-10% танинов и значительно меньше проблем с поиском и заготовкой. Я этот вариант не прорабатывал, т.к. собирание исходных компонентов в кучку + прикидочные опыты происходили в апреле-начале мая и с дикорастущим зверобоем была напряженка. А покупать в аптеке такую бросовую вещь, как трава зверобоя, религия не позволила. И нельзя объять необъятное, пусть другие пробуют по описанным методикам.
6. В принципе, можно пробовать толченые желуди, струганную кору ольхи, ели, лиственницы и т.п. Повторюсь — источников танинов навалом. А ежели по концентрации хватать не будет, всегда можно сильно упарить.
Проблемой являются только ионы железа в растворе. Нашарашить их по-быстрому в достаточном количестве из бросовых железяк в разбавленных р-рах несильных органических кислот вряд ли получится.
А теперь главное: после длительной возни с самопальными чернилами, обычная «Радуга» начинает восприниматься как технологическое чудо. Наверное, так оно и есть.
Всего доброго.
P.S. Эффект «проявления» чернил.
Уксусная вытяжка галлов + р-р цитрата из гвоздей.
Ускорение 4х:
 Исходное ВИДЕО (без ускорения).
Исходное ВИДЕО (без ускорения).А вот тоже самое через 20-30 мин. после писанины:
 Тоже самое на бумаге в клеточку:
Тоже самое на бумаге в клеточку:
Самые обсуждаемые обзоры
| +33 |
1727
52
|
Один пишет статьи по элементарной химии для неполных дигеров.
Другой — вынужден учить уроки по физкультуре…
Увы.
Внутри статьи нашла несколько знакомых букв.
Все образцы, которые на фото до сих пор хранятся при комнатной Т при свободном доступе воздуха. Писанина хуже не стала, бумага не разрушается. Через несколько часов, после полного высыхания и «проявления» что-либо перестает меняться. По крайней мере — в сторону ухудшения.
authenticmodels.com/lifestyle/writing/
А вот сами чернила у кого-то заказывают… никаких данных о производителе на банках нет (кроме букв АМ). Не будет же компания из Нидерландов размещать на своих банках иероглифы :)
Стекло люют тоже в Шанхае практически для всех японских и европейских фирм производящих чернила.
p.s.: а этой компанией не китаец владеет, случаем?
Но… эти чернила иногда в магазинах и маркетах продаются испорченными. История всплывала c 2016 года. У дефектных отлив в флаконе коричневый, на бумаге они серые, серо-черные, бурые но не сумрачное Северное море.
Pelikan 4001 Blue-Black там тоже фигурирует.)
Тем паче, Ваш пост с картинками в тыщу раз информативнее.
Это уже, не обзор, это уже опус получается.
Дочитал и ещё куда-нибудь плюсов накидаю)
Кольщика посадили в очередной раз, а я остался с неоконченным абстрактным портаком и гепатитом на память!
Скажите, а когда вы писали р-р, к-та, и-нет, вы буквы экономили, хотели чуть-чуть уменьшить объём текста или просто профессиональная привычка? =)
Мне кажется, что чем меньше в предложении лишних слов и букв, тем оно легче для восприятия. Возможно, ошибаюсь.
~~~~~~~~~~~~~~~~
На сей момент объем
без пробелов — 36 тыс. зн.
с пробелами — 41 тыс. зн.
Раньше на ресурсе было ограничение по объему 15 тыс. зн. (март 2019)
Какое сейчас — не в курсе.
Я понимаю, что столь объёмная писанина — это не есть хорошо. Причем, для всех. Но так получилось. Увы.
и это… третью надобно по законам любого жанра
Моё уважение автору
Надо больше таких авторов. Намного больше )
Спасибо автору за потраченное время!
Или Вы просто про антураж?))
Ну и размазываться…
Вообще экстрим с красителями удел энтузиастов ограниченных островных государств. Австралийцы от «жадности» пишут местными пищевыми красителями. У нас их не продают в 5 галонных бутылках, все в миниатюрной фасовке. Зато у нас залежи штемпельной краски, что сводит некоторых индивидуумов до желтого дома и истерик в среде обсуждения европейских чернил.
Как это повлияет на склонность к отслоению при мех. нагрузках (если жмакать бумагу или сгибать) — неведомо.
Нихрена не понятно, но, боже, до чего же интересно!!!
p.s.: круто, спасибо)
и к водостойким чернилам тоже вопрос, с ними ручка не разу не засыхала… есть у кого опыт?