Li из батареек
Я металл активный Литий,
Мягкий я и щелочной.
Лучше вы меня не злите,
Не шутите вы со мной!
Я охотно загораюсь –
Бойтесь моего огня!
И в воде я растворяюсь.
Лучше спрячьте вы меня
В вазелин, как будто в клетку,
Только так всегда храните.
И приклейте этикетку:
«Осторожно, это Литий!»
© детский портал «Солнышко»
Внимание! Если металлический литий не сильно нужен, то лучше не занимайтесь его извлечением из батареек.
Если вам все-таки неймется, то предлагаю ознакомиться с 4-мя основными моментами, изложенными в разделе 1.
Но если вы просто ищите приключений, то написанное в первом разделе не принимайте во внимание.
1.1. Начало начал — куда складировать
Перед тем как разбирать батарейку подготовьте емкость для хранения, заполненную жидкостью, с которой Li не будет взаимодействовать. Это может быть керосин, бензин, уайт-спирит и подобная органическая красота. Но они не должны содержать примесей, с которыми Li может взаимодействовать, даже медленно. А главное — не должно быть следов влаги!
Лично я рекомендую не заниматься ерундой, ибо все давно придумано и проверено.
Встречайте:
Масло вазелиновое медицинское по ГОСТ 3164-78. Для приема внутрь.
Без вкуса, цвета и запаха, абсолютно инертно относительно лития. Широкодоступно и стоит относительно недорого.
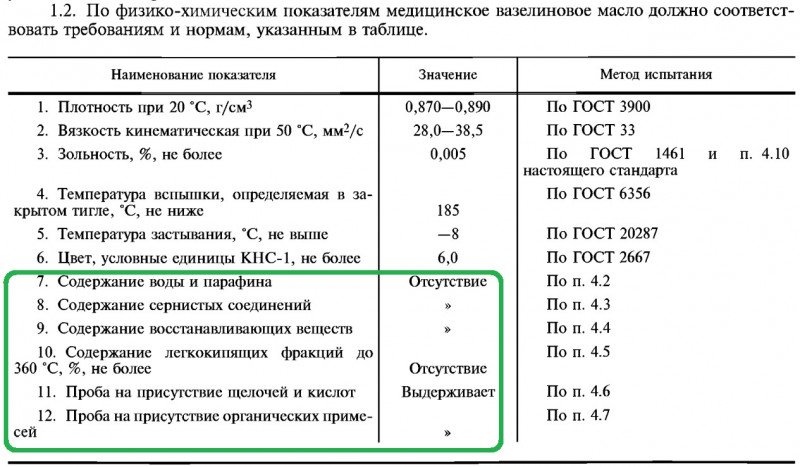
Из ГОСТ 3164-78:
Где купить? Да где угодно. В ближайшей аптеке или в инет-аптеке с бесплатной доставкой в офлайн-аптеки города.
Ориентировочная цена в розницу за 100 мл — 65...90 руб.
 Если указан ГОСТ на этикетке — то чисто в рекламных целях. Никаких ТУ для медицинского вазелинового масла вроде как не существует.
Если указан ГОСТ на этикетке — то чисто в рекламных целях. Никаких ТУ для медицинского вазелинового масла вроде как не существует.
Самые экономные могут приобрести по цене 8руб./100мл + доставка, но мелким оптом (20л в баклажках 4х5л) тут
И не связывайтесь с тем, что сейчас на маркет-плейсах продается как «Масло лампадное вазелиновое». С вероятностью >90% окажется абы что неизвестного состава.
Чисто теоретически должно быть:
Например, отсюда, 311 руб. за 1 литр:
И не важно, что это разводилово имеет посторонний запах или чадит-коптит. Нам сие как раз до лампады (каламбур-с). Важно, что ТАКОЕ есть результат паршивой очистки и может содержать что угодно. А оно нам надо?
Плотность лития составляет 0,534 г/см³. Плотность вазелинового масла 0.87-0.89.
А какая органическая жидкость самая легкая? Если рассматривать только жидкости, существующие при комнатной температуре и нормальном атмосферном давлении, то это изопентан (2-метилбутан). Его плотность 0,6197 г/см³ (при 20 °C).
Бесцветная летучая жидкость со слабым запахом бензина; tпл = –159,89 °C; tкип = +27,85 °C. Особенно порадовала температура кипения.;) И все равно литий на дно не пойдет. Оно нам такое надо?
Поэтому для не особо продолжительного хранения вполне себе попрет литий, свободно плавающий в керосине (ну очень хорошо очищенном) или в вазелиновом масле (медицинском, для приема перорально). Даже не знаю где вы найдете сверхчистый керосин (интересно — что это?), а чистенькое вазелиновое масло — в ближайшей аптеке.
Далее варианты для длительного хранения, найденные в интернетах.
► Где то читал, что литий топят в керосине путем заливки расплавленным твердым парафином. Он застывает и опускается на дно вместе с кусочками лития. Ибо плотность керосина ~0,8 г/см³, а тв. парафина ~0,9 г/см³.
Но тогда логичнее просто залить парафином «на сухую».
► «Что бы не всплывал, поместить литий в густой вазелин высокого качества». Возникает вопрос что это за вазелин. Скорее всего — медицинский ГОСТ 3582-84.
Только как потом литий очищать от того вазелина (если это вдруг понадобится)? Бензин как растворитель не указан, в остальном растворяется как-то неохотно.
Из ГОСТ 3582-84. Вазелин медицинский:
 Сравните — для вазелинового масла (ГОСТ 3164-78):
Сравните — для вазелинового масла (ГОСТ 3164-78):

► Из книжки Плющев В. E., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. М:1970 ТУТ
 Смысл хранения в тубах из алюминия или меди: упрощает пользование литием (можно отрезать кусок любой величины, не нарушая герметичность остатка).
Смысл хранения в тубах из алюминия или меди: упрощает пользование литием (можно отрезать кусок любой величины, не нарушая герметичность остатка).
Ссылка [41] -Гришин В. K. и др. Свойства лития. Металлургиздат, 1963.
В конце концов я нашел скрины этой довольно интересной и полезной книжки ТУТ.
На протяжение многих лет и до сих пор многие практические наработки, связанные с металлическим литием, копипастили из нее во всяко-разные издания. Но в прошлой жизни хотя бы давали ссылки на первоисточник, а в нонешних тырнетах этого обычно не происходит. Ибо после многократных копипаст копипасты от копипасты уже никто не знает откуда ноги растут.
► Поместить литий в полиэтиленовый пакет, вакуумировать и пакет запаять.
Короче, вариантов масса. Выбирай — не хочу.
Ниже я предложу еще один — гениальный в своей простоте.:)
Литий был открыт в 1817 г. (Арфведсон), а в виде простого вещества (металла) был получен в 1821 г. (Бранде, потом Дэви). С тех пор он считается щелочным металлом. Просто великому Хэмфри Дэви (первополучателю металлических Na, К, щелочноземельных металлов и много чего еще, включая «веселящий газ» N₂O) сильно хотелось, что бы Li был еще одним щелочным элементом.:) Ну, хотя бы потому, что Li таки активен и водород из воды вытесняет. При этом образуется сильное основание (щелочь) LiОН. И во всех своих соединениях Li одновалентен. «Чего же боле?» © А.С.Пушкин
Правда потом, чем глубже изучали химию лития, тем больше удивлялись: по большинству свойств Li и его соединения заметно отличался от «истинных» щелочных элементов (Na, К и т.д.) и как-то уж сильно походят на Mg и его соединения. После создания ПС Д.И.Менделеев был вынужден ввести понятие «диагональная аналогия». И самые яркие представители такого безобразия (с точки зрения школьной программы) являются пары Li-Mg и Be-Al.
 Ну да ладно. Тут самое важное для нас — это тот печальный факт, что LiОН все же щелочь. И в процессе разборки на поверхности металлического лития LiОН будет иметь место практически неминуемо. Больше или меньше — другой вопрос.
Ну да ладно. Тут самое важное для нас — это тот печальный факт, что LiОН все же щелочь. И в процессе разборки на поверхности металлического лития LiОН будет иметь место практически неминуемо. Больше или меньше — другой вопрос.
Поэтому 3 основных правила при работе с металлическим литием:
1) желательно не хватать литий голыми руками (пинцет и/или перчатки);
2) беречь глаза (защитные очки; не протирать глаз если он вдруг зачесался, сразу бежать в ванную) — щелочи даже в небольших количествах воздействуют на слизистую и начинают растворять роговицу глаза;
3) рядом держать кастрюльку с песком (на всякий пожарный случай).
Из заряженных литиевых батареек. Аккумуляторы Li-ion не подойдут.
Чем меньше разряжена батарейка, тем больше там осталось металлического лития.
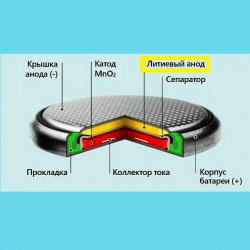
7 электрохимических систем с литиевым анодом (ГОСТ Р МЭК 60086-1):
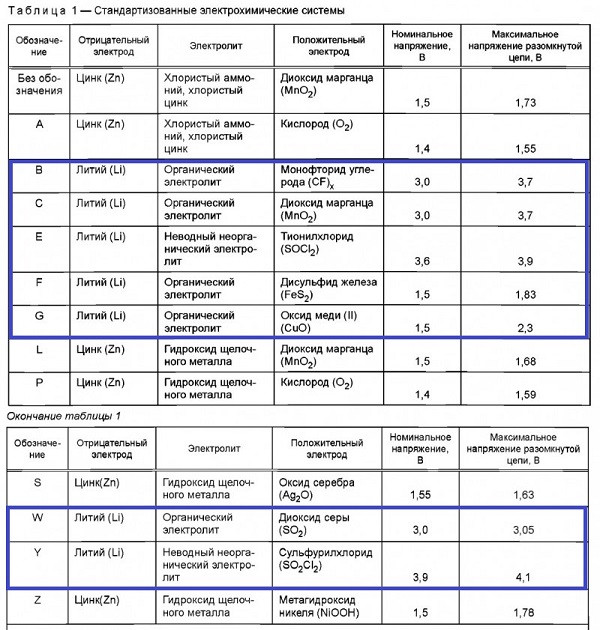 Самые доступные источники металлического лития — это литиевые батарейки:
Самые доступные источники металлического лития — это литиевые батарейки:
• формата АА (и другие цилиндрические)
• элементы CR2032.
Разборка цилиндрических:
видео-1, видео-2, видео-3(жесть).
Но куда как проще и в тыщу раз безопаснее разбирать CR2032, хотя Li там в несколько раз меньше, чем в АА.
ПЛАН разборки:
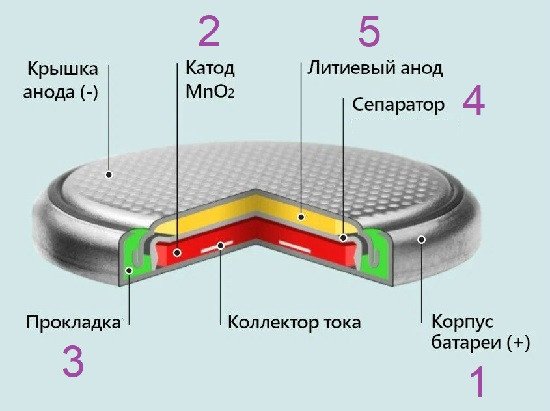 Но все оказалось куда как проще.
Но все оказалось куда как проще.
Сначала пытался отогнуть края плюсовой крышки разными мелкими плоскогубцами. Не получилось — плохо цепляют. Тогда попробовал БУ кусачки из маникюрного набора. Мне их отдала жена N лет назад, ибо они толи затупились, толи повредилась РК. Уж не знаю, что она с ними делала, но явно не использовала по назначению. А для выполнения данной операции они подошли отлично — кант крышки не режется, но замечательно цепляется и отгибается. Правда с усилием, особенно в начале. После разгерметизации сразу появляется несильный, но явный запах какого-то орг. растворителя: основа электролита батарейки.
Прошелся по периметру и вуаля — батарейка разделилась на 2 части: минусовая крышка с наплавленным литием + все остальное. Что и требовалось.
 Из остального можно наковырять MnO₂ — он там в виде черной слабо спрессованной таблетки и легко разваливается
Из остального можно наковырять MnO₂ — он там в виде черной слабо спрессованной таблетки и легко разваливается
 В ходе разборки другого экземпляра удалось извлечь хрупкую таблетку MnO₂ без разрушения. Вот так выглядит плюсовый коллектор тока, впрессованный в MnO₂:
В ходе разборки другого экземпляра удалось извлечь хрупкую таблетку MnO₂ без разрушения. Вот так выглядит плюсовый коллектор тока, впрессованный в MnO₂:

Крышку с литием сразу же взвесил. Ниже объясню зачем.
Литий легко ковыряется ножом, типа как пластилин на морозе. В прошлой жизни я отрезал тупым лабораторным ножиком кусочки от бруска натрия — насколько помню, он примерно такой же мягкий. Что и не удивительно, твердость по шкале Мооса
• литий 0.6
• натрий 0.5
 Далее по плану — полностью избавиться от лития с крышки. Элементарно, Ватсон:
Далее по плану — полностью избавиться от лития с крышки. Элементарно, Ватсон:
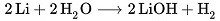
 Через несколько минут реакция заканчивается. Дно крышки сияет как новое. Вынимаем пинцетом, промокаем салфеткой, слегка подсушиваем и взвешиваем.
Через несколько минут реакция заканчивается. Дно крышки сияет как новое. Вынимаем пинцетом, промокаем салфеткой, слегка подсушиваем и взвешиваем.
Результат:
 Получается, что лития в CR2032 примерно 0.1 г.
Получается, что лития в CR2032 примерно 0.1 г.
А сколько его в литиевых АА? Авторы видосов (см. выше) почему-то не догадались взвесить литиевые полоски.
Нашел только такую рекламную картинку:
 С какого перепуга малое содержание лития преподносится как некая фича, лично мне не понятно. Я бы сей момент наоборот, скрывал.:) Но маркетологам виднее.
С какого перепуга малое содержание лития преподносится как некая фича, лично мне не понятно. Я бы сей момент наоборот, скрывал.:) Но маркетологам виднее.
Ежели что, то масса сабжевой CR2032 до потрошения была 2.88 г.
 ► Конечно, по массе АА и CR2032 сравнивать некорректно, ибо форм-факторы шибко разные, но в качестве грубой оценки получается 16/2.88=5.56 раз. Кроме того, есть CR2032, имеющие массу немного больше 3 г. См. подборку от ув. ACE. Но там явной корреляции между емкостью и массой CR2032 как бы не прослеживается.
► Конечно, по массе АА и CR2032 сравнивать некорректно, ибо форм-факторы шибко разные, но в качестве грубой оценки получается 16/2.88=5.56 раз. Кроме того, есть CR2032, имеющие массу немного больше 3 г. См. подборку от ув. ACE. Но там явной корреляции между емкостью и массой CR2032 как бы не прослеживается.
► Еще можно сравнить по емкости: 3000мАч/~230мАч=13 раз. Но тогда в АА «Энергия» должно быть лития ~1.3 г.:) И опять-таки сравнение некорректное.
У CR2032 рабочий диапазон напряжений 3...2В, а у литиевых АА 1.5...0.8В. Что как бы намекает, что «химия» у них разная. См. табличку вверху, про 7 электрохимических систем.
► В общем, как говорилось в старинной миниатюре А.Райкина «Рекбус, краксворд...»
Куда сливать растворы, полученные после растворения лития в воде? Да куда угодно: в раковину, в унитаз и т.д. Дело в том, что это щелочные р-ры типа средств для прочистки а-ля «Крот».
Но перед тем как избавится от того щелочного раствора, я решил замерить его pH. У меня где-то валяется универсальная индикаторная бумага, но я ее не нашел. Зато в процессе поисков внезапно обнаружилась старинная лакмусовая бумага***, про которую все давным-давно забыли.
***Прим. То, что сейчас китайцы продают как «лакмусовая бумага» это ни что иное как универсальная индикаторная бумага (она желтая изначально). А лакмусовая нынче практически не выпускается. Но горевать по этому поводу не стоит, ибо при одинаковой копеечной цене универсальная на порядок информативнее лакмусовой.
Раритет был выпущен в марте 1989, срок годности — 2 года. Удивительно, хоть и слабо, но работает до сих пор:
 У не столь древней бумаги цвета значительно насыщеннее и переход более заметен.
У не столь древней бумаги цвета значительно насыщеннее и переход более заметен.
Только вот универсальная бумага дает хоть и грубую, но всеж-таки количественную оценку pH среды, а ламусовая — увы.
С другой стороны, pH нетрудно посчитать. Для этого нужно знать массу растворившегося Li (≈0.1 г), массу получившегося раствора и его плотность. Плотность сильно разбавленных водных растворов принимается равной 1 г/см³.
Масса 124.48-88.88=35.6 г. V≈35.6 см³=3.56·10⁻² дм³.
 По определению: pH = -lg[H⁺]
По определению: pH = -lg[H⁺]
[H⁺] — это концентрация ионов H⁺ в единицах моль/дм³
Ионное произведение воды при 22ºС: Kw = 10⁻¹⁴ = [H⁺][OH⁻]
[H⁺] = 10⁻¹⁴/[OH⁻] => pH = -lg(10⁻¹⁴/[OH⁻])
Число молей Li: n = 0.1(г)/6.94(г/моль) = 0.0144 моль
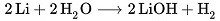 По уравнению реакции из 1 моль Li получается 1 моль LiОН.
По уравнению реакции из 1 моль Li получается 1 моль LiОН.
LiОН — щелочь, на ионы распадается полностью и необратимо => из 1 моль LiОН получается 1 моль OH⁻.
Собираем все в кучу:
[OH⁻] = [LiOH⁻] = 1.44·10⁻²(моль)/3.56·10⁻²(дм³) = 0.404 моль/дм³.
pH = -lg(10⁻¹⁴/0.404) = -lg(2.47·10⁻¹⁴) = 14 — lg(2.47) = 14 — 0.39 ≈ 13.6
Среда получается ну очень сильно щелочная. А с учетом того, что раствор 0.4 моль/дм³ не так что бы сильно разбавленный (плотность около 1.012 г/см³), то pH там будет ≈14 без вариантов.
Что из этого следует? БЕРЕЧЬ ГЛАЗА!
Из книжки Гришин В. K. и др. Свойства лития. Металлургиздат, 1963:
 PS. Следует учитывать, что шкала pH не линейная, а логарифмическая.
PS. Следует учитывать, что шкала pH не линейная, а логарифмическая.
Поэтому если растворить 0.1 г Li не в 35 мл, а 3.5 л воды pH понизится всего на 2 единицы. Увы.
PPS. Особенно эффективен для прочистки сантехники от всяко-разной органики сухой гранулированный NaOH (и это правда). Всего 5-7 грамм NaOH(тв.) на пол стакана воды — и вы имеете шанс получить полный комплекс ощущений как у того несчастного кролика. Имейте ввиду.
Очевидно, что почти полным отсутствием лития на аноде…
Но, для очистки совести, надо проверить что там да как.
Разрядил еще один непользованный CR2032 PKCELL через резистор 674Ω до 0.45В
Кривая разряда отсюда
 Вскрытие показало, что литий по центру блямбы «съеден» практически полностью, даже видна фактура крышки. По краям — остатки лития, потемневшие в процессе разглядывания и фотографирования. Это слой оксонитрида лития (в нулевом приближении смесь Li₃N+Li₂О). Темную окраску оксонитриду придает Li₃N.
Вскрытие показало, что литий по центру блямбы «съеден» практически полностью, даже видна фактура крышки. По краям — остатки лития, потемневшие в процессе разглядывания и фотографирования. Это слой оксонитрида лития (в нулевом приближении смесь Li₃N+Li₂О). Темную окраску оксонитриду придает Li₃N.
 Взвесил, бросил в воду и даже снял ВИДЕО.
Взвесил, бросил в воду и даже снял ВИДЕО.
Да, следы лития имеются. Но по сравнению с крышкой от заряженного акку — детский лепет и по продолжительности бурления и по интенсивности оного; теперь жалею что тогда не заснял видос.
Взвешивание «до» и «после». Разница 0.01г равна разрешающей способности весов.
 Как говорится, что и требовалось доказать.
Как говорится, что и требовалось доказать.
Идея возникла, когда я первый раз ковырял литиевая блямбу на минусовой крышке CR2032. Адгезия Li к никелированной стали внушала уважение, тонкая пленка лития все равно оставалась на никеле и я подумал: «Зачем я это делаю? В чем смысл?»
— Литий на минусовой крышке однозначно утонет в том же вазелиновом масле.
— Для многих экспериментов с литием подложка, на которой никель, не будет мешать.
— В случае чего, наковырять нужное количество лития с подложек можно прямо перед экспериментом.
Практических применений для металлического лития я пока не придумал.
Правда, есть одна идея, но практическая реализация в домашних условиях под большим вопросом.
Если есть желание просто «похимичить», то вот пара ознакомительных видосов:
Эксперименты с ЛИТИЕМ
ЛИТИЙ И 10 РАЗНЫХ ЖИДКОСТЕЙ
Заодно можно оценить степень потенциальной опасности ряда экспериментов.
На этом пока всё.
Всего доброго.

Мягкий я и щелочной.
Лучше вы меня не злите,
Не шутите вы со мной!
Я охотно загораюсь –
Бойтесь моего огня!
И в воде я растворяюсь.
Лучше спрячьте вы меня
В вазелин, как будто в клетку,
Только так всегда храните.
И приклейте этикетку:
«Осторожно, это Литий!»
© детский портал «Солнышко»
Внимание! Если металлический литий не сильно нужен, то лучше не занимайтесь его извлечением из батареек.
Если вам все-таки неймется, то предлагаю ознакомиться с 4-мя основными моментами, изложенными в разделе 1.
Но если вы просто ищите приключений, то написанное в первом разделе не принимайте во внимание.
1. База
1.1. Начало начал — куда складировать нажитое непосильным трудом металлический литий
Перед тем как разбирать батарейку подготовьте емкость для хранения, заполненную жидкостью, с которой Li не будет взаимодействовать. Это может быть керосин, бензин, уайт-спирит и подобная органическая красота. Но они не должны содержать примесей, с которыми Li может взаимодействовать, даже медленно. А главное — не должно быть следов влаги!
Лично я рекомендую не заниматься ерундой, ибо все давно придумано и проверено.
Встречайте:
Масло вазелиновое медицинское по ГОСТ 3164-78. Для приема внутрь.
Без вкуса, цвета и запаха, абсолютно инертно относительно лития. Широкодоступно и стоит относительно недорого.
Из ГОСТ 3164-78:

Где купить? Да где угодно. В ближайшей аптеке или в инет-аптеке с бесплатной доставкой в офлайн-аптеки города.
Ориентировочная цена в розницу за 100 мл — 65...90 руб.
 Если указан ГОСТ на этикетке — то чисто в рекламных целях. Никаких ТУ для медицинского вазелинового масла вроде как не существует.
Если указан ГОСТ на этикетке — то чисто в рекламных целях. Никаких ТУ для медицинского вазелинового масла вроде как не существует.Самые экономные могут приобрести по цене 8руб./100мл + доставка, но мелким оптом (20л в баклажках 4х5л) тут
Про терминологию: парафин, твердый парафин, жидкий парафин
1) «Парафин» в химии:
парафины = предельные углеводороды = насыщенные углеводороды = алканы = углеводороды из гомологического ряда метана.
Статья на xumuk.ru
По-простому: в химии «парафин» любой предельный углеводород определенного состава. В том числе и газообразные метан, этан, пропан и бутан.
2) «Парафин» в технике и промышленности. Различают «твердый парафин» (обычный парафин) и «жидкий парафин» (вазелиновое масло).
Это не индивидуальные хим. соединения (алканы), а их сложные смеси переменного состава.
По-простому: твердый парафин — это то, из чего делают свечи, а жидкий пьют при запоре.
3) Обычный парафин (твердый при Ткомн):
• смесь предельных углеводородов С₁₈-C₃₅,
• преимущественно нормального строения [линейные молекулы, без циклов и разветвлений],
• с молярной массой 300-400,
• бесцветные кристаллы с Тпл 45-65ºС,
• плотность 0,880-0,915 г/см3 (15ºС),
• не растворим в воде и этаноле,
• растворяется в большинстве орг. растворителей, минеральных маслах.
• Инертен по отношению к большинству хим. реагентов при Ткомн.
Статья на xumuk.ru
4) У жидкого парафина основные (самые длинные) цепи С-С короче, чем у твердого.
Примерно С₁₀-C₁₅. ссылка 1, ссылка 2
парафины = предельные углеводороды = насыщенные углеводороды = алканы = углеводороды из гомологического ряда метана.
Статья на xumuk.ru
По-простому: в химии «парафин» любой предельный углеводород определенного состава. В том числе и газообразные метан, этан, пропан и бутан.
2) «Парафин» в технике и промышленности. Различают «твердый парафин» (обычный парафин) и «жидкий парафин» (вазелиновое масло).
Это не индивидуальные хим. соединения (алканы), а их сложные смеси переменного состава.
По-простому: твердый парафин — это то, из чего делают свечи, а жидкий пьют при запоре.
3) Обычный парафин (твердый при Ткомн):
• смесь предельных углеводородов С₁₈-C₃₅,
• преимущественно нормального строения [линейные молекулы, без циклов и разветвлений],
• с молярной массой 300-400,
• бесцветные кристаллы с Тпл 45-65ºС,
• плотность 0,880-0,915 г/см3 (15ºС),
• не растворим в воде и этаноле,
• растворяется в большинстве орг. растворителей, минеральных маслах.
• Инертен по отношению к большинству хим. реагентов при Ткомн.
Статья на xumuk.ru
4) У жидкого парафина основные (самые длинные) цепи С-С короче, чем у твердого.
Примерно С₁₀-C₁₅. ссылка 1, ссылка 2
И не связывайтесь с тем, что сейчас на маркет-плейсах продается как «Масло лампадное вазелиновое». С вероятностью >90% окажется абы что неизвестного состава.
Чисто теоретически должно быть:
ru.wikipedia.org/wiki/Вазелиновое_маслоВ реале масло лампадное с маркет-плейсов как правило не столь замечательно.
В церквях и исторических зданиях масло вазелиновое медицинское (масло медицинское белое высшего качества) используют вместо растительных масел в лампадах. В результате полного сгорания жидкого парафина образуется диоксид углерода и водяной пар — в отличие от растительных масел и воска, вазелиновое не даёт осаждения копоти и сажи на настенных фресках и росписях.
Например, отсюда, 311 руб. за 1 литр:

Из отзывов на Я-Маркете по другому лоту
И не важно, что это разводилово имеет посторонний запах или чадит-коптит. Нам сие как раз до лампады (каламбур-с). Важно, что ТАКОЕ есть результат паршивой очистки и может содержать что угодно. А оно нам надо?
1.2. Увы, но литий сам по себе не утонет
Плотность лития составляет 0,534 г/см³. Плотность вазелинового масла 0.87-0.89.
А какая органическая жидкость самая легкая? Если рассматривать только жидкости, существующие при комнатной температуре и нормальном атмосферном давлении, то это изопентан (2-метилбутан). Его плотность 0,6197 г/см³ (при 20 °C).
Бесцветная летучая жидкость со слабым запахом бензина; tпл = –159,89 °C; tкип = +27,85 °C. Особенно порадовала температура кипения.;) И все равно литий на дно не пойдет. Оно нам такое надо?
Поэтому для не особо продолжительного хранения вполне себе попрет литий, свободно плавающий в керосине (ну очень хорошо очищенном) или в вазелиновом масле (медицинском, для приема перорально). Даже не знаю где вы найдете сверхчистый керосин (интересно — что это?), а чистенькое вазелиновое масло — в ближайшей аптеке.
Далее варианты для длительного хранения, найденные в интернетах.
► Где то читал, что литий топят в керосине путем заливки расплавленным твердым парафином. Он застывает и опускается на дно вместе с кусочками лития. Ибо плотность керосина ~0,8 г/см³, а тв. парафина ~0,9 г/см³.
Но тогда логичнее просто залить парафином «на сухую».
► «Что бы не всплывал, поместить литий в густой вазелин высокого качества». Возникает вопрос что это за вазелин. Скорее всего — медицинский ГОСТ 3582-84.
Только как потом литий очищать от того вазелина (если это вдруг понадобится)? Бензин как растворитель не указан, в остальном растворяется как-то неохотно.
Из ГОСТ 3582-84. Вазелин медицинский:
 Сравните — для вазелинового масла (ГОСТ 3164-78):
Сравните — для вазелинового масла (ГОСТ 3164-78):
► Из книжки Плющев В. E., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. М:1970 ТУТ
 Смысл хранения в тубах из алюминия или меди: упрощает пользование литием (можно отрезать кусок любой величины, не нарушая герметичность остатка).
Смысл хранения в тубах из алюминия или меди: упрощает пользование литием (можно отрезать кусок любой величины, не нарушая герметичность остатка).Ссылка [41] -Гришин В. K. и др. Свойства лития. Металлургиздат, 1963.
В конце концов я нашел скрины этой довольно интересной и полезной книжки ТУТ.
На протяжение многих лет и до сих пор многие практические наработки, связанные с металлическим литием, копипастили из нее во всяко-разные издания. Но в прошлой жизни хотя бы давали ссылки на первоисточник, а в нонешних тырнетах этого обычно не происходит. Ибо после многократных копипаст копипасты от копипасты уже никто не знает откуда ноги растут.
► Поместить литий в полиэтиленовый пакет, вакуумировать и пакет запаять.
Короче, вариантов масса. Выбирай — не хочу.
Ниже я предложу еще один — гениальный в своей простоте.:)
1.3. Литий достаточно активный металл и даже местами «щелочной»
Литий был открыт в 1817 г. (Арфведсон), а в виде простого вещества (металла) был получен в 1821 г. (Бранде, потом Дэви). С тех пор он считается щелочным металлом. Просто великому Хэмфри Дэви (первополучателю металлических Na, К, щелочноземельных металлов и много чего еще, включая «веселящий газ» N₂O) сильно хотелось, что бы Li был еще одним щелочным элементом.:) Ну, хотя бы потому, что Li таки активен и водород из воды вытесняет. При этом образуется сильное основание (щелочь) LiОН. И во всех своих соединениях Li одновалентен. «Чего же боле?» © А.С.Пушкин
Правда потом, чем глубже изучали химию лития, тем больше удивлялись: по большинству свойств Li и его соединения заметно отличался от «истинных» щелочных элементов (Na, К и т.д.) и как-то уж сильно походят на Mg и его соединения. После создания ПС Д.И.Менделеев был вынужден ввести понятие «диагональная аналогия». И самые яркие представители такого безобразия (с точки зрения школьной программы) являются пары Li-Mg и Be-Al.
 Ну да ладно. Тут самое важное для нас — это тот печальный факт, что LiОН все же щелочь. И в процессе разборки на поверхности металлического лития LiОН будет иметь место практически неминуемо. Больше или меньше — другой вопрос.
Ну да ладно. Тут самое важное для нас — это тот печальный факт, что LiОН все же щелочь. И в процессе разборки на поверхности металлического лития LiОН будет иметь место практически неминуемо. Больше или меньше — другой вопрос. При нормальных условиях литий медленно взаимодействует с воздухом.
Взаимодействие твердого лития сильно зависит от состояния его поверхности, наличия в литии примесей, влажности, температуры (тут подробнее).
Протекающие реакции***:
***Примечание1) Из первых трех реакций наиболее активно протекает третья — взаимодействие Li с Н₂О. На самом деле, воды в воздухе не так уж и много. Даже при относительной влажности 100% в 1дм³ воздуха при 20ºС всего 0.017 г Н₂О (0.01 моль/л)
Но и этого вполне себе хватает для более активного протекания реакции с Н₂О (по сравнению с N₂ и O₂) при образовании первоначальной (доли секунды) поверхностной пленки на литии во влажном воздухе.
2) Хотя N₂ + O₂ в воздухе ~98-99%, Li взаимодействует с ними куда как более вяло, чем с водой. А самое удивительное — литий взаимодействует с N₂ даже при 0ºС. И эта реакция превалирует над реакцией с O₂! Это одно из проявлений диагональной аналогии Li-Mg, хотя Mg все-таки кислород любит больше чем азот. При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида.
Есть ли еще хотьодин металлодно простое вещество, которое проявляет такое химическое сродство к молекулярному азоту как Li? Лично я не могу припомнить.
А вот истинные щелочные металлы паталогически любят кислород. При любой возможности они пытаются нахапать его сверх меры и образовать перекисные соединения (пероксиды Me₂O₂, надпероксиды MeO₂ и даже озониды MeO₃). Для них даже существует проблема получения обычных нормальных оксидов Me₂O без примесей перекисных соединений. А нитриды для них малохарактерны.
В относительно «сухом» воздухе (влажность заметно меньше 40-50%) основным первоначальным продуктом взаимодействия лития с воздухом является Li₃N с примесями Li₂O и LiOH. А при высокой влажности (80% и более) сразу получается смесь Li₂CO₃ с LiOH в соотношении ~1:3 плюс примесь нитрида Li₃N.
Длительное хранение на воздухе с ненулевой влажностью неминуемо приводит к деградации Li₃N и полному переходу в смесь Li₂CO₃+LiOH.
Поэтому 3 основных правила при работе с металлическим литием:
1) желательно не хватать литий голыми руками (пинцет и/или перчатки);
2) беречь глаза (защитные очки; не протирать глаз если он вдруг зачесался, сразу бежать в ванную) — щелочи даже в небольших количествах воздействуют на слизистую и начинают растворять роговицу глаза;
3) рядом держать кастрюльку с песком (на всякий пожарный случай).
1.4. Откуда выковыривать литий
Из заряженных литиевых батареек. Аккумуляторы Li-ion не подойдут.
Чем меньше разряжена батарейка, тем больше там осталось металлического лития.
7 электрохимических систем с литиевым анодом (ГОСТ Р МЭК 60086-1):
 Самые доступные источники металлического лития — это литиевые батарейки:
Самые доступные источники металлического лития — это литиевые батарейки:• формата АА (и другие цилиндрические)
• элементы CR2032.
Разборка цилиндрических:
видео-1, видео-2, видео-3(жесть).
Но куда как проще и в тыщу раз безопаснее разбирать CR2032, хотя Li там в несколько раз меньше, чем в АА.
2. Практика
2.1 Основные моменты
ПЛАН разборки:
 Но все оказалось куда как проще.
Но все оказалось куда как проще.Сначала пытался отогнуть края плюсовой крышки разными мелкими плоскогубцами. Не получилось — плохо цепляют. Тогда попробовал БУ кусачки из маникюрного набора. Мне их отдала жена N лет назад, ибо они толи затупились, толи повредилась РК. Уж не знаю, что она с ними делала, но явно не использовала по назначению. А для выполнения данной операции они подошли отлично — кант крышки не режется, но замечательно цепляется и отгибается. Правда с усилием, особенно в начале. После разгерметизации сразу появляется несильный, но явный запах какого-то орг. растворителя: основа электролита батарейки.
Прошелся по периметру и вуаля — батарейка разделилась на 2 части: минусовая крышка с наплавленным литием + все остальное. Что и требовалось.
 Из остального можно наковырять MnO₂ — он там в виде черной слабо спрессованной таблетки и легко разваливается
Из остального можно наковырять MnO₂ — он там в виде черной слабо спрессованной таблетки и легко разваливается В ходе разборки другого экземпляра удалось извлечь хрупкую таблетку MnO₂ без разрушения. Вот так выглядит плюсовый коллектор тока, впрессованный в MnO₂:
В ходе разборки другого экземпляра удалось извлечь хрупкую таблетку MnO₂ без разрушения. Вот так выглядит плюсовый коллектор тока, впрессованный в MnO₂:
Крышку с литием сразу же взвесил. Ниже объясню зачем.
Литий легко ковыряется ножом, типа как пластилин на морозе. В прошлой жизни я отрезал тупым лабораторным ножиком кусочки от бруска натрия — насколько помню, он примерно такой же мягкий. Что и не удивительно, твердость по шкале Мооса
• литий 0.6
• натрий 0.5
 Далее по плану — полностью избавиться от лития с крышки. Элементарно, Ватсон:
Далее по плану — полностью избавиться от лития с крышки. Элементарно, Ватсон: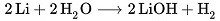
 Через несколько минут реакция заканчивается. Дно крышки сияет как новое. Вынимаем пинцетом, промокаем салфеткой, слегка подсушиваем и взвешиваем.
Через несколько минут реакция заканчивается. Дно крышки сияет как новое. Вынимаем пинцетом, промокаем салфеткой, слегка подсушиваем и взвешиваем.Результат:
 Получается, что лития в CR2032 примерно 0.1 г.
Получается, что лития в CR2032 примерно 0.1 г.А сколько его в литиевых АА? Авторы видосов (см. выше) почему-то не догадались взвесить литиевые полоски.
Нашел только такую рекламную картинку:
 С какого перепуга малое содержание лития преподносится как некая фича, лично мне не понятно. Я бы сей момент наоборот, скрывал.:) Но маркетологам виднее.
С какого перепуга малое содержание лития преподносится как некая фича, лично мне не понятно. Я бы сей момент наоборот, скрывал.:) Но маркетологам виднее.Ежели что, то масса сабжевой CR2032 до потрошения была 2.88 г.
 ► Конечно, по массе АА и CR2032 сравнивать некорректно, ибо форм-факторы шибко разные, но в качестве грубой оценки получается 16/2.88=5.56 раз. Кроме того, есть CR2032, имеющие массу немного больше 3 г. См. подборку от ув. ACE. Но там явной корреляции между емкостью и массой CR2032 как бы не прослеживается.
► Конечно, по массе АА и CR2032 сравнивать некорректно, ибо форм-факторы шибко разные, но в качестве грубой оценки получается 16/2.88=5.56 раз. Кроме того, есть CR2032, имеющие массу немного больше 3 г. См. подборку от ув. ACE. Но там явной корреляции между емкостью и массой CR2032 как бы не прослеживается.► Еще можно сравнить по емкости: 3000мАч/~230мАч=13 раз. Но тогда в АА «Энергия» должно быть лития ~1.3 г.:) И опять-таки сравнение некорректное.
У CR2032 рабочий диапазон напряжений 3...2В, а у литиевых АА 1.5...0.8В. Что как бы намекает, что «химия» у них разная. См. табличку вверху, про 7 электрохимических систем.
► В общем, как говорилось в старинной миниатюре А.Райкина «Рекбус, краксворд...»
2.2. Про щелочную среду после взаимодействия с водой
Куда сливать растворы, полученные после растворения лития в воде? Да куда угодно: в раковину, в унитаз и т.д. Дело в том, что это щелочные р-ры типа средств для прочистки а-ля «Крот».
Но перед тем как избавится от того щелочного раствора, я решил замерить его pH. У меня где-то валяется универсальная индикаторная бумага, но я ее не нашел. Зато в процессе поисков внезапно обнаружилась старинная лакмусовая бумага***, про которую все давным-давно забыли.
***Прим. То, что сейчас китайцы продают как «лакмусовая бумага» это ни что иное как универсальная индикаторная бумага (она желтая изначально). А лакмусовая нынче практически не выпускается. Но горевать по этому поводу не стоит, ибо при одинаковой копеечной цене универсальная на порядок информативнее лакмусовой.
Раритет был выпущен в марте 1989, срок годности — 2 года. Удивительно, хоть и слабо, но работает до сих пор:
 У не столь древней бумаги цвета значительно насыщеннее и переход более заметен.
У не столь древней бумаги цвета значительно насыщеннее и переход более заметен.Только вот универсальная бумага дает хоть и грубую, но всеж-таки количественную оценку pH среды, а ламусовая — увы.
С другой стороны, pH нетрудно посчитать. Для этого нужно знать массу растворившегося Li (≈0.1 г), массу получившегося раствора и его плотность. Плотность сильно разбавленных водных растворов принимается равной 1 г/см³.
Масса 124.48-88.88=35.6 г. V≈35.6 см³=3.56·10⁻² дм³.
 По определению: pH = -lg[H⁺]
По определению: pH = -lg[H⁺][H⁺] — это концентрация ионов H⁺ в единицах моль/дм³
Ионное произведение воды при 22ºС: Kw = 10⁻¹⁴ = [H⁺][OH⁻]
[H⁺] = 10⁻¹⁴/[OH⁻] => pH = -lg(10⁻¹⁴/[OH⁻])
Число молей Li: n = 0.1(г)/6.94(г/моль) = 0.0144 моль
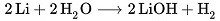 По уравнению реакции из 1 моль Li получается 1 моль LiОН.
По уравнению реакции из 1 моль Li получается 1 моль LiОН.LiОН — щелочь, на ионы распадается полностью и необратимо => из 1 моль LiОН получается 1 моль OH⁻.
Собираем все в кучу:
[OH⁻] = [LiOH⁻] = 1.44·10⁻²(моль)/3.56·10⁻²(дм³) = 0.404 моль/дм³.
pH = -lg(10⁻¹⁴/0.404) = -lg(2.47·10⁻¹⁴) = 14 — lg(2.47) = 14 — 0.39 ≈ 13.6
Среда получается ну очень сильно щелочная. А с учетом того, что раствор 0.4 моль/дм³ не так что бы сильно разбавленный (плотность около 1.012 г/см³), то pH там будет ≈14 без вариантов.
Что из этого следует? БЕРЕЧЬ ГЛАЗА!
Из книжки Гришин В. K. и др. Свойства лития. Металлургиздат, 1963:
 PS. Следует учитывать, что шкала pH не линейная, а логарифмическая.
PS. Следует учитывать, что шкала pH не линейная, а логарифмическая. Поэтому если растворить 0.1 г Li не в 35 мл, а 3.5 л воды pH понизится всего на 2 единицы. Увы.
PPS. Особенно эффективен для прочистки сантехники от всяко-разной органики сухой гранулированный NaOH (и это правда). Всего 5-7 грамм NaOH(тв.) на пол стакана воды — и вы имеете шанс получить полный комплекс ощущений как у того несчастного кролика. Имейте ввиду.
2.3. Чем отличаются полностью заряженные батарейки от сильно разряженных?
Очевидно, что почти полным отсутствием лития на аноде…
Но, для очистки совести, надо проверить что там да как.
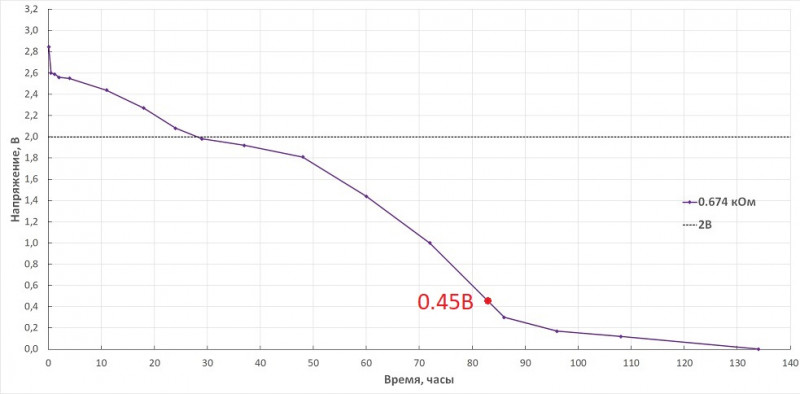
Разрядил еще один непользованный CR2032 PKCELL через резистор 674Ω до 0.45В
Кривая разряда отсюда
 Вскрытие показало, что литий по центру блямбы «съеден» практически полностью, даже видна фактура крышки. По краям — остатки лития, потемневшие в процессе разглядывания и фотографирования. Это слой оксонитрида лития (в нулевом приближении смесь Li₃N+Li₂О). Темную окраску оксонитриду придает Li₃N.
Вскрытие показало, что литий по центру блямбы «съеден» практически полностью, даже видна фактура крышки. По краям — остатки лития, потемневшие в процессе разглядывания и фотографирования. Это слой оксонитрида лития (в нулевом приближении смесь Li₃N+Li₂О). Темную окраску оксонитриду придает Li₃N. Взвесил, бросил в воду и даже снял ВИДЕО.
Взвесил, бросил в воду и даже снял ВИДЕО.Да, следы лития имеются. Но по сравнению с крышкой от заряженного акку — детский лепет и по продолжительности бурления и по интенсивности оного; теперь жалею что тогда не заснял видос.
Взвешивание «до» и «после». Разница 0.01г равна разрешающей способности весов.
 Как говорится, что и требовалось доказать.
Как говорится, что и требовалось доказать.2.4. Нижняя крышка CR2032 — отличный способ хранения лития в утопленном состоянии
Идея возникла, когда я первый раз ковырял литиевая блямбу на минусовой крышке CR2032. Адгезия Li к никелированной стали внушала уважение, тонкая пленка лития все равно оставалась на никеле и я подумал: «Зачем я это делаю? В чем смысл?»
— Литий на минусовой крышке однозначно утонет в том же вазелиновом масле.
— Для многих экспериментов с литием подложка, на которой никель, не будет мешать.
— В случае чего, наковырять нужное количество лития с подложек можно прямо перед экспериментом.
Зачем добывать литий?
Практических применений для металлического лития я пока не придумал.
Правда, есть одна идея, но практическая реализация в домашних условиях под большим вопросом.
Если есть желание просто «похимичить», то вот пара ознакомительных видосов:
Эксперименты с ЛИТИЕМ
ЛИТИЙ И 10 РАЗНЫХ ЖИДКОСТЕЙ
Заодно можно оценить степень потенциальной опасности ряда экспериментов.
На этом пока всё.
Всего доброго.

Самые обсуждаемые обзоры
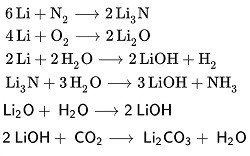
Рука-лицо.jpg
Но многое из того, что изложено в статье, далеко за рамками школьной программы. Даже советской.
Вы не находите?
А вот что действительно нового, так это то, что литий вдруг стал больше похож на магний, чем на другие щелочные металлы.
Ну и ладно.
За
обзоризвлечение Li — лайк!Система открытая с двух сторон…
Унитаз, вещь довольно крепкая. Способен пережить падение в грунт с высоты башенного крана. Лично наблюдал. Взрыв, способный разорвать унитаз, должен выбить дверь санузла, залить всё кипятком и засыпать кусками горящего натрия.
С той поры прошло немало лет, унитазы может и не стали крепче, а вот крепление унитаза цементом к чугунной фанине ушло в прошлое, так что максимум гофру сорвёт. Да и натрия, наверное, в школах уже нет. Ах, да, бачки под потолком тоже больше не существуют, а обычный эконом бачок ком бумаги вглубь унитаза не продавит. Так что тренироваться современным школьникам нечем и не на чем, ушла эпоха.
И всё бы ничего, но самое узкое место в каналье — это сифон внутри унитаза. Если уж он дошел до чугунины (стандартный диаметр 110мм), то в ней он уж точно не застрянет. Ну серьёзно, хватит уже выдумывать )
Слушайте, а сколько по вашему хранили натрия в школьном кабинете химии?
У чугунины в унитазе ваще-та диаметр 125, если Вы не в курсе. Дальше она заходит в горизонтальную с уклоном 150ую и идет до стояка, который 200 или 250. Это в советском школьном сортире, где пять-шесть толчков в ряд.
1987 год. В лаборантской стоял один невскрытый жбан 10 кг, один вскрытый уполовиненный. Калий в литровых банках темного стекла, брусками, сколько банок — не считал, не знаю. Картонная бочка бертолетовки, килограмм наверное 20 =) Это что я видел, это в лаборантской кабинета физики я был царь и бог, а в химическую заносило редко и за конкретным надом. А уж сколько ртути тогда было в школе, то никому неведомо, сотни килограмм.
В школе… пятнадцать килограмм щелочного металла? Бочка бертолетовой соли. Двадцать кило. Не в стекле, не в укупорке, а вот прямо в картоне, одной массой. Сотни килограмм ртути. В школе?! Гражданин, у вас точно температуры нет?
Он реально верит в свои безудержные фантазии.
Это одно из странных свойств долговременной памяти у сапиенсов.
А возможно и у всех высших приматов. Британские учёные пока не поверяли.
И что там пишут то, "продолжают иметь место случаи хранения металлической ртути".
Даже в 1994, заметьте, году. Ртутный шухер начался, в общем-то, с развалом СССР, когда обнаружилось, что эту особо вредную и дорогую жидкость можно невозбранно приватизировать в целях утилизации. Ну и провести дорогостоящие мероприятия по демеркуризации.
Ладно, считайте, что я художественно насвистел, мне как-то побоку.
Мебель запихивали на чердак, когда один хулиган поджег там гипердымовуху и приехали пожарные — директор хорошо получил по башке, а хлам с чердаков несколько дней таскали на школьный двор.
Бардак, да. И курить на черной лестнице можно было почти официально =) консервная банка на каждом этаже стояла, только что таблички не висели «место для курения».
Ну вот мы и дошли до мякотки — «Одна бабка сказала». А что так поскромничали то? Написали бы сразу — десять тонн ртути. Или пятнадцать, чтобы прям наверняка )
Окей, с одной сказкой от Барона Мюнхгаузена мы разобрались.
Теперь хочется услышать про, цитирую: «Картонная бочка бертолетовки, килограмм наверное 20» )
Это кто рекомендует?
Не надо читать Перельмана, чтобы понять где в этой легенде косяк. Просто погуглите плотность натрия.
Лет 50 назад мы чтобы добыть литий (или натрий? или калий? я хз) и посмотреть как он в воде шипит (а иногда даже огонёк был небольшой!) распиливали клапана от машин, только не во всех клапанах попадался, вот иногда обидно было — пилишь, пилишь, а внутри ничего! Мне вот до сих пор интересно — а нафига он там?! Никто не знает?
При рабочей температуре клапана натрий находится в жидком состоянии, наверно за счет этого лучше передает тепло.
Канал с натрием наполнен примерно наполовину. В прогретом движке натрий плавится и взбалтывается, находясь в состоянии металлического крупнодисперсионного аэрозоля.
И не понятно почему если срабатывает капсуль, то не возгорается порох? Так ведь вроде и задумано- от срабатывания капсуля возгорается порох в гильзе.
потому вылетает первым, гильза становится не герметичной и много энергии вылетает через это отверстие, но для вылета пули тоже хватает энергии как и на разрыв гильзы.
а в оружии ствол и затвор не дают ни капсулю вылететь ни гильзе разорваться.
но это не точно.
Но всё равно не страшно. Хлопает оно громко, но вреда сильного причинить не может (ну если в глаз не отлетит).
сейчас даже загуглил.
dzen.ru/a/XJ2_sn2_qAC1YvAu?ysclid=m914p6hs4563806243
Или доставали порох из арт.снарядов (макаронины «семидыр»), заворачивали в фольгу, поджигали.
На значок «классность», «гто», а тем более «гвардия» можно много чего было наменять… ДВ, Амурская область.
Обертывали его фольгой, поджигали, притушивали ногой — такой густой зеленый дым валил! :)
ещё монтажные патроны выменивали — одно из применений — пробка, в которой что-то то горючее, морилка например — и сверху патрон на проволочке сантиметрах в 5, типа спиртовки получается.
ну и естественно поджечь и убежать)
Я даже не представляю себе, что было бы, если советский школьник мог как сейчас зайти в первый попавшийся магазин и просто купить упаковку бенгальских огней. Это было бы страшно…
В аптеке спокойно покупалась марганцовка за 4 копейки и люголь за 10 что ли. Глицерин аптечный был разбодяжен водой, с ним ничего не получалось.
А вот выпросить у мороженщицы большой кусок сухого льда перед обеденным перерывом или в конце дня это да, это всему двору радость. Вот только ПЭТ бутылок тогда не было, а в стекло устанешь запихивать.
Но марганец это еще пол беды — магний, вот где был настоящий затык. А сейчас — вон, пошёл и купил. Хочешь пачку, хочешь сразу ящик. Не хочешь перетирать бенгальские огни — вон на Озоне можно чистый порошок заказать. Вообще не проблема.
Бензобак, ой, батарейка, у теслы 700кг например, ну, минус корпус, сепараторы, ведро чипов, пара километров проводов…
Не, если теслы на батарейках сделали, тогда да…
Автор хитрая жо, начни ты с этого пункта статью, стал бы я читать всю эту простыню. А так да, где мои 8-14 лет, где я что только не курочил…
ЕГЭ?
А вот это не очень умно.
Правильный ответ: «Сам топи урановые ломы в ртути!» ©
Госспади, неужели я такой старый?..
youtube.com/shorts/Z3YKWzcZldM?feature=shared
Соли лития окрашивают пламя в красный цвет.
Правда, у меня банка нитрата стронция стоит, но вот чисто ради интереса надо батарейки таким образом утилизировать =)
Продолжаю наблюдение, завтра может до ближайшей церковной лавки дойду, мне скоро деревяшки уличные надо будет пропитывать, вот думаю вазелиновое покрасить и ага.
Интересно, кто минусит, ПГМовцы чтоле или барыги с озона?)
Тема то про то, что уже давно лампадное масло это медицинское вазелиновое, прямые поставки, так в России. Конечно не исключены в каких либо глубинках эрзац, но то уже местная особенность.
А пропитывать заборы вазелином это как то по буржуйски… :)
Только как как простому хоум-юзеру, у которого нет даже простейшего масляного насоса и элементарной газовой стеклодувки под рукой «откачать воздух и запаять с двумя контактами»?
Вот зачем это делать с литием, я не понял. Мне надо несколько ламп ccfl ультрафиолетовых, на али нужного размера (длина 300 диаметр до 6 мм) не нашел, вот прямо думаю — не запилить ли самому? Еще лет 10 назад у рекламщиков все было для неона — и трубки, и электроды, и газы, и источники высоковольтные. А теперь кукиш, одни светодиоды.
Впрочем, танталовая проволока свободно продается и так, в отличие от платиновой.
Затем, что я как-то не наблюдаю в продаже светодиодов 253 нм по адекватной цене.
А $30 за 5 штук 0,2W я адекватной ценой не считаю, да и доверия к этому ноунейму нет, на заборе тоже написано.
ну и я опасаюсь, что при температуре свечения спирали железная проволочка повиснет на полшестого =)
Впрочем, мне это не поможет, поэтому пусть обратно тонет — и так голова забита всякой ерундой, аж череп жмёт.
https://aliexpress.ru/item/1005006037057589.html
Если расковырять обычную щелочную батарейку ( черный поглотитель с марганцовкой), а потом эту кашицу ( «мокрую» от щелочи) выбросить в мусорку где лежат куски туалетной ( или подобной) бумаги, то мусорная корзинка вполне может самовоспламениться. Если бы сам не столкнулся — не поверил бы. Хотя возгорание сахара от марганцовки с серной кислотой — вроде как классика. Заметил, к счастью, на стадии тления. дымок, запах горелой бумаги. На бумаге уже был огонек — тление, не горение. Пришлось добежать до ванной комнаты и заливать ведерко водичкой. Думал, что только литий выброшенный в мусор может стать зомби-батарейкой.
====
пост от 4 апреля, не от 1-го!